Les analyses canines & félines
Lexique des analyses
Biologie : prélèvement et interprétation
Immuno-hématologie
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours réfrigéré ou à T° ambiante
Interprétation :
Les anticorps anti-nucléaires (AcAn) peuvent être utiles dans la démarche diagnostique du Lupus Erythémateux Systémique (LES). L’expression clinique est variée (ex. fièvre, polyarthrite non-erosive, adénomégalie, splénomégalie, atteinte rénale, atteinte cutanée/muqueuse) avec des changements hématologiques possibles (ex. AHMI, thrombopénie ou leucopénie).
Critères diagnostiques du LES : présence de signes d’atteinte auto-immune avec un titre en AcAn élevé.
La sensibilité de la mesure des AcAn est très bonne : presque tous les patients présentant un taux élevé d’AcAn seront détectés (LES ou non), un résultat négatif écarte donc un LES.
En revanche, la spécificité et la valeur prédictive positive sont faibles : un résultat positif peut accompagner une multitude d’autres maladies qu’un LES, ex. maladies inflammatoires infectieuses (en particulier FIV et FeLV, Ehrlichia et Leishmania), néoplasmes, certains médicaments. 15% des chiens sains peuvent même présenter des AcAn (en particulier le Berger Allemand). Un résultat positif devra donc toujours être confronté à la présentation clinique. En général, les titres les plus élevés accompagnent les formes cliniques les plus sévères lorsque la maladie est avérée.
Conditions de prélèvement :
Sang total EDTA
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Le test de coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes (processus auto-immun ou à médiation immunitaire si intervention d’antigènes exogènes comme un agent infectieux, médicament, etc.).
Il existe environ 30-50% de faux négatifs (faible titrage en anticorps, corticothérapie récente, délai d’analyse) et d’occasionnels faux positifs (ex. foyers inflammatoires chroniques ou tumeurs lymphoïdes). En revanche, la réalisation d’une transfusion préalablement au test de Coombs ne semble pas entraîner de faux positifs.
Chez un chien ou un chat présentant des signes cliniques et biologiques en faveur d’une AHMI, un test de Coombs direct positif peut donc être considéré comme très en faveur d’une telle anémie. Il ne permet cependant pas de déterminer si l’AHMI est primaire ou secondaire (à un processus infectieux ou néoplasique, par exemple).
Conditions de prélèvement :
Envoi de 1-2 lames (si possible non colorées) avec un tube de sang total EDTA.
Conservation et stabilité du frottis sanguin (si envoi différé) : indéterminée (T°ambiante, non exposé aux vapeurs de formol)
Après prélèvement, le sang doit être rapidement transféré dans un tube EDTA. Le frottis doit être réalisé dans les plus brefs délais, à partir d’un échantillon sanguin frais et bien homogénéisé, pour prévenir toute dégradation morphologique des cellules. La préparation du frottis commence par le dépôt d’une goutte de sang (au moyen d’un tube capillaire) à l’extrémité de la lame. Cette goutte est ensuite étalée au moyen d’une seconde lame qui est glissée sur la première (photos 1a et 1b). Bien préparé, le frottis sanguin prend l’apparence d’une “langue de chat”. Cela indique que l’échantillon a été étalé correctement et permet l’observation d’un frottis sanguin de qualité.
La coloration se réalise de façon standard (Diff-Quick®, RAL®, Wright-Giemsa). Le frottis préparé doit être sec (séchage rapide à l’air par agitation des lames) avant coloration.
Pour mettre spécifiquement en évidence les réticulocytes, une coloration au nouveau bleu de méthylène peut être réalisée. Dans un tube en plastique, une goutte de sang est mélangée à une ou deux gouttes de nouveau bleu de méthylène. Le tube est laissé à température ambiante pendant 5-10 minutes. Une petite goutte du mélange est ensuite déposée sur une lame et étalée de la même façon que pour la réalisation du frottis sanguin. La lame est séchée rapidement à l’air et examinée au fort grossissement du microscope (× 50 à 100).

Interprétation :
En savoir plus sur :
– L’examen systématique du frottis sanguin
– L’évaluation des érythrocytes
– L’évaluation des plaquettes et des leucocytes
Conditions de prélèvement :
Sang veineux prélevé dans un tube EDTA.
Le tube EDTA est homogénéisé doucement et immédiatement après la ponction pour assurer le bon mélange anticoagulant-sang.
Le sang capillaire est utile pour la détection de certains parasites au frottis sanguin.
Un frottis sanguin est idéalement réalisé à la clinique et envoyé avec le tube EDTA (morphologie cellulaire préservée).
Conservation et stabilité du tube EDTA (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Anémie
Son interprétation repose sur l’évaluation de sa sévérité, la connaissance du comptage des réticulocytes (chien et chat) et une évaluation du frottis sanguin.
Le comptage des réticulocytes permet de déterminer le caractère régénérateur ou non de l’anémie au moment de la prise de sang chez le chien et le chat. Cette information est essentielle car elle permet de mieux trouver la cause de l’anémie. Les réticulocytes peuvent aussi être comptés au microscope avec une coloration spéciale (bleu de méthylène).
Une anémie est dite régénérative si les réticulocytes dépassent un certains seuil. La régénération témoigne de l’activité de la moelle osseuse. Une anémie régénérative s’explique par deux processus principaux :
1. Des pertes sanguines (saignements qui peuvent être internes ou externes)
2. Une hémolyse, ex. anémie hémolytique à médiation immunitaire, dommages oxydatifs, infection comm une piroplasmose ou une hémobartonellose.
Lors d’anémie non-régénérative la moelle osseuse ne produit pas ou pas suffisamment d’hématies. Il peut s’agir d’une anémie inflammatoire ou d’une anémie de maladie rénale chronique. L’absence de régénération peut aussi être lié à une atteinte structurelle et fonctionnelle de la moelle osseuse (ex : leucémie par remplacement du tissu normal). Enfin, une anémie hémorragique ou hémolytique sera d’abord non régénérative durant les 3-4 premiers jours suivants le début de l’affection.
Erythrocytose
On parle d’érythrocytose lorsque la masse érythrocytaire circulante est augmentée. On la détecte lorsque l’un des paramètres érythroides (Htc, Hg ou hématies) au moins est augmenté. Le plus souvent, ce changement est peu significatif et dit »relatif ». Dans ce cas, une hémoconcentration (déshydratation) ou une contraction splénique (stress) sont les principales causes. Un suivi est alors envisageable pour exclure une erythrocytose « absolue ».
Les érythrocytose absolues peuvent être primaires ou secondaires.
L’érythrocytose absolue secondaire peut elle-même être »appropriée » ou inappropriée ».
– L’érythrocytose absolue secondaire appropriée fait suite à une augmentation de la valeur de l’EPO qui est causée par une hypoxie systémique : maladies cardio-vasculaires. Ce groupe est également assez fréquent.
– L’érythrocytose absolue secondaire inappropriée est causée par une production (augmentation) de la valeur de l’EPO dans le sang, sans hypoxie. La production autonome d’EPO peut être d’origine rénale (kyste ou tumeur rénale) ou provenir d’une tumeur d’autre organe : hépatome, hepatoblastome, schannome, leiomyosarcome. Ces causes sont plutôt rares.
L’érythrocytose absolue primaire est (très) rare : la production d’hématies dans la moelle osseuse est autonome et anormale; la valeur de l’EPO est physiologique : c’est la polycytémie vera (leucémie érythroïde chronique).
Leucocytose
Son interprétation passe par l’évaluation de la sévérité de la leucocytose, de la formule (différentiel leucocytaire c’est-à-dire prédominance ou non d’un type de leucocyte) et enfin de la morphologie des cellules, évaluées au frottis sanguin.
– Leucogramme de stress :
Celui-ci se caractérise par une leucocytose neutrophilique qui peut être jusqu’à modérée. Une monocytose légère/modérée et une lymphopénie légère peuvent aussi être présentes.
– Leucogramme inflammatoire :
Une neutrophilie légère, modérée voire marquée est possible. Une neutropénie est également possible (plus rare). La lecture du frottis est intéressant pour rechercher des changements toxiques et une déviation de la courbe d’Arneth à gauche. Une monocytose légère à modérée est possible. Une lymphocytose réactionnelle est parfois possible.
– Leucocytose lors de néoplasme / hémopathie maligne : la lecture du frottis est indispensable. Il faut rechercher la présence de cellules atypiques circulantes et en apprécier les détails morphologiques.
La majorité des cas sont une leucémie ou un lymphome (stade V avec phase leucémique).
On différencie des leucémies « chroniques » et leucémies « aigues ». La démarche diagnostique des leucémies nécessite souvent l’évaluation de la moelle osseuse par un myelogramme.
– Autre :
Une lymphocytose légère avec une éosinophilie peut être présente dans les cas de maladie d’Addison (absence de formule de stress). La cortisolémie après stimulation à l’ACTH, la kaliémie, la natrémie et le ratio NA/K restent nécessaires à son diagnostic.
Une lymphocytose modérée (jusqu’à 17.103 /microL) peut être observée lors d’Ehrlichiose chronique. Les lymphocytes peuvent alors être à grains et une hypergammaglobulinémie peut être présente.
Leucopénie
La numération leucocytaire est abaissée dans son ensemble. Il faut tenir compte de la sévérité, du contexte clinique et de la formule pour bien l’interpréter. La neutropénie est le changement (le plus fréquent) qui affecte les granulocytes neutrophiles :
– Une neutropénie marginale peut être peu significative, en particulier si elle est constatée chez un animal âgé qui vit en intérieur et avec un bon état général.
– Une neutropénie légère à marquée peut aussi être secondaire à un foyer inflammatoire (rare chez le chien et le chat). Dans ce cas, la moelle ne produit pas assez de cellules en réponse à la demande (certains cas de péritonites, de pyomètres à col fermé, etc.). Ceci peut être transitoire ou au contraire le signe d’un épuisement de la moelle osseuse. Le frottis pourra révéler des signes de toxicité et une déviation de la courbe d’Arneth à gauche (une neutropénie de type dégénérative est très significative).
Une panleucopénie se caractérise par une diminution de la numération de tous les types leucocytaires : c’est un changement significatif. Les pathologies sous jacentes peuvent être variées et incluent des causes néoplasiques (ex. leucémie, lymphome), infectieuse (ex. parvovirose canine, panleucopénie féline, certains cas de FeLV) et toxiques.
La lymphopénie est souvent »isolée » et sans leucopénie. Parmi les causes les plus fréquentes, un effet du stress (corticostéroides endogènes) et une origine virale sont à prioriser.
Thrombopénie
Les grands processus pathologiques à l’origine d’une thrombopénie sont :
– Une consommation des plaquettes (ex. saignements notamment par anticoagulants, CIVD)
– Une destruction des plaquettes « à médiation immunitaire »
– Une anomalie de production des plaquettes (toxiques, agents infectieux, néoplasme)
Il est important d’exclure un artéfact par évaluation du frottis sanguin. La présence d’amas de plaquettes devrait notamment être recherchée. Il faut aussi s’assurer qu’il n’y a pas de caillot dans le tube EDTA.
Thrombocytose
Ce changement est souvent peu significatif. La thrombocytose est souvent dite »réactionnelle », accompagnant de nombreuses pathologies sous jacentes (inflammatoire, néoplasique, etc).
Hémostase
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Les D-Dimères résultent de la dégradation de la fibrine.
L’augmentation des D-dimères reflète un état hypercoagulable (thrombose voire CIVD) : ex. affections tumorales (hémangiosarcome, leucémie, sarcome histiocytaire,…), anémie hémolytique à médiation immunitaire, sepsis (et autres pathologies inflammatoires sévères), affections hépatiques, pancréatite, torsion d’organe, transfusion, hémorragie interne, etc.
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Une activité de moins de 30 % du facteur VIII est diagnostique de l’hémophilie A avec des conséquences cliniques probables. Lorsque la concentration plasmatique de facteur VIII est comprise entre 1 et 5 %, l’affection est rapidement létale.
Au-delà de 30 %, l’affection est considérée comme mineure.
Les femelles porteuses ont une concentration de facteur VIII de 50 à 70 %. Ce dosage permet de les dépister et de les retirer de la reproduction.
Les tests de l’exploration de l’hémostase sont souvent normaux. Le temps de céphaline activée (TCA) est augmenté si la déficience en facteur VIII est majeure (> 75%).
L’hémophilie A est décrite chez le chien, le chat et le cheval. Ce type d’hémophilie est le plus répandu. Portée par le chromosome X et récessive, l’anomalie est majoritairement symptomatique chez le mâle (symptomatique chez la femelle quand les deux chromosomes X sont touchés).
La gravité des signes cliniques est proportionnelle à la sévérité de la mutation, donc à la déficience en facteur VIII. De très nombreuses mutations existent, à l’origine de formes cliniques très variées.
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Une activité de moins de 30 % du facteur IX est diagnostique de l’hémophilie B avec des conséquences cliniques probables.
Au-delà de 30 %, l’affection est considérée comme mineure.
Les femelles porteuses ont une concentration de facteur IX de 50 à 70 %. Ce dosage permet de les dépister et de les retirer de la reproduction.
Les tests de l’exploration de l’hémostase sont souvent normaux. Le temps de céphaline activée (TCA) est augmenté si la déficience en facteur IX est majeure (> 75%).
L’hémophilie B, déficit en facteur IX, est moins fréquente que l’hémophilie A. Portée par le chromosome X et récessive, l’anomalie est majoritairement symptomatique chez le mâle (symptomatique chez la femelle quand les deux chromosomes X sont touchés). L’hémophilie B est décrite dans de nombreuses races de chat et de chien. Le diagnostic différentiel avec l’hémophilie A est impossible du fait de la similitude des symptômes.
Un dosage différentiel des facteurs de coagulation (VIII et IX) s’impose.
Les autres déficits congénitaux sont tous transmis de manière autosomale et sont peu fréquents. Ils sont souvent des découvertes fortuites lors d’une exploration de la coagulation plasmatique. Les saignements spontanés sont rares (déficit en facteur X) et surviennent souvent après des traumatismes (déficit en facteurs I et XI). Aucun déficit en facteurs V, XIII et HMWK n’a été décrit chez le Chien et le Chat.
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
En général, un résultat inférieur à 30% permet de confirmer la maladie de von Willebrand. Un chien présentant un résultat intermédiaire (50-65%) est le plus souvent asymptomatique mais considéré comme « porteur ».
Le facteur de von Willebrand (fvW) est une glycoprotéine plasmatique composée de multimères (les plus lourds sont les plus fonctionnels). Le fvW permet surtout l’adhésion des plaquettes au collagène des vaisseaux. Il contribue aussi à l’agrégation des plaquettes entre elles. C’est aussi le transporteur du facteur VIII de la coagulation (le Temps de Céphaline Activée peut être augmenté en cas de maladie de von Willebrand). Les races prédisposées sont : Doberman, Berger Allemand, Pinsher, Scottish, Schnauzer miniature, Golden Retriever.
Cette maladie héréditaire est décrite sous 3 formes :
Type1
– Le plus fréquent en particulier chez le Doberman Pinsher
– Tous les multimères sont présents mais en quantité diminuée
– Maladie de sévérité variable
Type2
– Rare et surtout chez le Pointer
– La quantité des multimères de grande taille est particulièrement diminuée
– Forme clinique sévère
Type3
– Plutôt chez le Scottish, le Retriever et le Berger des Shetland
– Tous les multimères sont absents
– Forme clinique sévère
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Le fibrinogène peut être diminué en cas de surconsommation (comme d’autres facteurs de la coagulation et les plaquettes) : ex. thrombose, CIVD, saignements abondants.
Les déficiences congénitales sont très rarement décrites en médecine vétérinaire.
Une hyperfibrinogénémie est généralement secondaire à un processus inflammatoire (marqueur moins fiable que la protéine C-réactive ou le SAA).
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Les causes d’augmentation du TCA sont similaires à celles du temps de Quick (notamment pathologie hépatique sévère, CIVD et intoxication aux rodenticides).
Lors d’augmentation isolée du TCA, il est recommandé de répéter le test (sensibilité du facteur VIII à la chaleur lors du transport du plasma).
Une augmentation isolée et significative du TCA (sans biais pré-analytique, persistante et au-delà de 30% des normes) peut aussi être secondaire à un déficit congénital (ex. hémophilie A – facteur VIII, maladie de Willebrand).
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Lors d’augmentation du temps de Quick, les causes à envisager sont une pathologie hépatique sévère, une CIVD (D-dimères souvent augmentés et plaquettes souvent basses dans ce cas), et une intoxication aux rodenticides.
Un déficit congénital en facteurs de coagulation est très rare.
Biochimie
Conditions de prélèvement :
Sérum exclusivement (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Hyperglobulinémie en alpha +/- béta (polyclonale) :
Cette hyperglobulinémie indique une inflammation « aigue » ou « active ». En effet, l’augmentation de la production des protéines de la phase aiguë (ex. SAA, haptoglobine, Protéine C réactive) peut causer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (infection, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
Hyperglobulinémie en béta (polyclonale) :
Cette hyperglobulinémie indique une inflammation « subaigue – chronique ». En particulier, l’augmentation de la production de certaines immunoglobulines (ex. IgA, IgM) et de certaines protéines du complément peut causer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (infection, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
Hyperglobulinémie en béta et gamma (polyclonale) :
Cette hyperglobulinémie indique une inflammation « subaigue – chronique ». En particulier, l’augmentation de la production de certaines immunoglobulines (ex. IgA, IgM et IgG) et de certaines protéines du complément peut causer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (infection, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
N.B : en cas d’atteinte hépatique chronique (surtout décrit dans l’espèce équine), il est possible d’observer un « pont béta-gamma » (limite indistincte entre ces 2 fractions protéiques).
Hyperglobulinémie en gamma (polyclonale) :
Cette hyperglobulinémie indique une inflammation « chronique » (> 1 semaine). En particulier, l’augmentation des immunoglobulines (IgG) et des protéines du complément peut engendrer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (PIF, Ehrlichiose, Leishmaniose, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
Hyperglobulinémie monoclonale en gamma (gammopathie monoclonale) :
Cette hyperglobulinémie correspond probablement à la production d’un seul type d’immunoglobuline, par un « clone » de lymphocytes B ou de plasmocytes. Une tumeur lymphoïde peut être recherchée en priorité : lymphome, leucémie lymphoïde, myélome multiple, plasmocytome.
Dans de rares cas, une hyperglobulinémie « non-néoplasique » peut engendrer une gammopathie monoclonale : ex. Ehrlichiose canine, pyodermite chronique, Leishmaniose, certains processus dysimmunitaires.
Cas particuliers :
Péritonite infectieuse féline :
Les anomalies classiques en cas de PIF sont une augmentation des alpha et béta-globulines par l’hypersécrétion de protéines positives de l’inflammation aiguë (serum amyloïd A, haptoglobine et a1-glycoprotéine, notamment) et une augmentation polyclonale (exceptionnellement monoclonale) des gamma-globulines, due à une stimulation lymphoplasmocytaire accrue. Ces modifications ne sont pas pathognomoniques (faible valeur prédictive positive), mais le diagnostic de PIF est très peu probable en cas d’absence de modification du protéinogramme (valeur prédictive négative proche de 100 %).
Aussi, un rapport albumine/globulines augmenté (> 0,6) est très peu en faveur d’un diagnostic de PIF, alors qu’un rapport diminué (< 0,6) oriente vers un diagnostic de PIF sans permettre pour autant d’établir le diagnostic (d’autres maladies sont possibles telles qu’un lymphome, un myélome multiple, une infection par le FIV, un processus inflammatoire chronique, etc.).
Leishmaniose :
La leishmaniose est à l’origine d’une réponse immunitaire particulière dont les caractéristiques sont directement liées à la progression de la maladie. Tant que l’immunité cellulaire prévaut sur l’immunité humorale, l’expression clinique est peu intense, voire inexistante. Lorsque la maladie progresse et s’aggrave, la stimulation lymphoplasmocytaire qui en résulte se traduit par une production accrue d’immuno-globulines. Sur le tracé électrophorétique, une progression des alpha 2-globulines et une augmentation en béta ou en gamma-globulines polyclonales, rarement oligoclonales et exceptionnellement monoclonales, sont observées. Une élévation des béta-globulines et une diminution de l’albuminémie sont également fréquemment notées. Ces modifications protéiques permettent la détermination du stade de la maladie chez le chien, nécessaire à l’adaptation thérapeutique.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La fructosamine est le produit d’une réaction non enzymatique irréversible (glycation) entre le glucose sanguin et les acides aminés des protéines sériques dont l’albumine principalement. Elle est le reflet de la glycémie moyenne au cours des 2-3 semaines précédant le prélèvement (non affectée par l’hyperglycémie de stress mais ne détecte pas les variations de la glycémie comme l’effet Somogyi).
Suivi du diabète sucré :
Les valeurs attendues durant le traitement se situent entre 350 et 450 µmol/l.
Une analyse urinaire peut être faite conjointement (recherche d’une cétonurie et d’une glucosurie notamment) et une courbe de glycémie peut être réalisée dès 7-10 jours après le début du traitement si la réponse clinique ne semble pas satisfaisante. La mesure de la glycémie seule n’est pas utile (sauf pour écarter un pic d’hypoglycémie).
Rappel : certains facteurs d’insulino-résistance (outre la génétique) doivent être recherchés avant mise en place ou modification du traitement : pancréatite, obésité, syndrome de Cushing, hypothyroïdie, progestagènes notamment.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La fructosamine est le produit d’une réaction non enzymatique irréversible (glycation) entre le glucose sanguin et les acides aminés des protéines sériques dont l’albumine principalement. Chez le Chat, elle est le reflet de la glycémie moyenne au cours des sept derniers jours précédant le prélèvement (peu ou pas affectée par l’hyperglycémie de stress mais ne détecte pas les variations de la glycémie comme l’effet Somogyi).
La sensibilité de la fructosamine pour le diagnostic de diabète sucré chez le chat est de 86 à 93 % selon les études. Parmi les causes de résultats faussement négatifs, on retrouve non seulement le diabète sucré débutant associé à une hyperglycémie modérée < 3,6 g/L (< 20 mmol/L) mais également l’hypoprotéinémie et l’hyperthyroïdie qui font chuter la fructosaminémie.
La spécificité de la fructosamine est estimée entre 55 et 86 % chez le Chat, notamment en raison d’hyperglycémies modérées associées à des maladies chroniques, avec pour conséquence une augmentation discrète de la fructosamine.
Suivi du diabète sucré :
Les valeurs attendues durant le traitement se situent entre 350 et 450 µmol/l.
Le contrôle glycémique est considéré moyen entre 450 et 550 µmol/l, et mauvais au-delà de 550 µmol/l.
Une courbe de glycémie est recommandée dès 5-10 jours après le début du traitement. La mesure de la glycémie seule n’est pas utile (sauf pour écarter un pic d’hypoglycémie).
Une analyse urinaire peut être faite conjointement (recherche d’une cétonurie et d’une glucosurie notamment). L’hyperglycémie de stress (transitoire) est parfois importante chez le chat, et peut s’accompagner d’une glucosurie (environ 20% des cas lorsque le seuil glycémique de 270 mg/dl est dépassé).
Rappel : certains facteurs d’insulino-résistance (outre la génétique) doivent être recherchés avant mise en place ou modification du traitement : obésité, inactivité physique, acromégalie, pancréatite, progestagènes, glucocorticoïdes notamment.
Conditions de prélèvement :
Sérum (tube sec) rapidement séparé
Conservation et stabilité : envoi sous 24h si possible réfrigéré sinon congélation à – 20°C (stable plusieurs jours/semaines)
Interprétation :
Le NT-proBNP est un biomarqueur cardiaque fonctionnel. Son augmentation est synonyme d’insuffisance cardiaque (dysfonctions systolique et/ou diastolique, surcharge volémique) ou d’hypertension pulmonaire chez le chien et le chat.
Il peut être intéressant dans les situations suivantes chez le chien :
– Diagnostiquer une cardiopathie si > 900 pmol/l. De plus, la valeur du NT-proBNP augmente avec la sévérité de l’insuffisance cardiaque.
– Le dosage du NT-proBNP permet d’approximer le délai avant décompensation lors de maladie valvulaire mitrale non décompensée. Une valeur > 466 pmol/l permet de prédire une décompensation à 1 an chez ces animaux. Une valeur > 1500 pmol/l indique une décompensation.
– Le dosage du NT-proBNP permet d’établir un pronostic de survie lors d’insuffisance cardiaque, chez le chien présentant une maladie valvulaire mitrale.
Chez les animaux insuffisants cardiaques de stades 2 et 3 confondus, la durée de vie médiane est de 146 jours pour une valeur > 1 500 pmol/l. Pour une valeur < 1 500 pmol/l, la durée de vie médiane est supérieure à 6 mois.
Chez les animaux insuffisants cardiaques de stade 2, une valeur > 1 265 pmol/l établit une médiane de survie de 130 jours, une valeur < 1 265 pmol/l, une médiane supérieure à 6 mois.
Enfin, chez les animaux insuffisants cardiaques de stade 3, une valeur > 2 700 pmol/l correspond à une médiane de survie de 5 jours, une valeur < 2 700 pmol/l, à une médiane supérieure à 6 mois.
– Le dosage du NT-proBNP prédit aussi la durée de survie lors de maladie valvulaire mitrale chez le chien traité. Une valeur < 965 pmol/l indiquerait une espérance de vie de 500 jours chez 50 % des chiens, une valeur > 965 pmol/l après la mise en place d’un traitement, une espérance de vie de 200 jours chez 50 % des chiens.
– Le NT-proBNP aide au diagnostic d’une cardiomyopathie chez le doberman, quel que soit le stade (occulte ou non). Une valeur > 400 pmol/l peut permettre le diagnostic.
En phase occulte, avec ou sans autre examen, une valeur > 457 pmol/l peut permettre le diagnostic (avec une forte certitude si > 900 pmol/l).
Il peut être intéressant dans les situations suivantes chez le chat :
– Diagnostiquer une cardiopathie : une valeur < 90 pmol/l écarte totalement une cardiopathie, une valeur >150 pmol/l la confirme avec certitude. Entre ces 2 valeurs le résultat peut être douteux.
– Le NT-proBNP permet le diagnostic différentiel entre une maladie cardiaque et une maladie respiratoire chez le chat. Une valeur seuil de 265 pmol/l peut séparer les animaux présentant une dyspnée aiguë secondaire à une maladie cardiaque de ceux présentant une dyspnée aiguë secondaire à une pneumopathie pure.
– Le NT-proBNP est utile pour le diagnostic étiologique différentiel d’un épanchement pleural d’origine cardiaque ou d’une autre origine (infectieuse ou tumorale, par exemple). Une valeur supérieure > 258 pmol/l permet d’orienter l’épanchement pleural vers une origine cardiaque.
– Une valeur du NT-proBNP > 250 pmol/l indique un pronostic vital lors de cardiomyopathie hypertrophique d’une durée médiane de 764 jours, contre 1 257 jours si la valeur est < 250 pmol/l.
Certaines affections extracardiaques peuvent être associées à une élévation du NT-proBNP : hyperthyroïdie, azotémie, hypertension artérielle, syndrome inflammatoire sévère.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Tout syndrome inflammatoire (immun, infectieux, nécrose, traumatisme, etc.) entraîne une synthèse hépatique de protéine C-réactive. La production est très précoce et suit une variation exponentielle de sa concentration plasmatique dès 4-6 heures après l’initiation du stimulus inflammatoire, avec un pic atteint à 24-48 heures. Sa concentration chute rapidement dans les 24 heures suivant la résolution du processus inflammatoire.
La CRP a une valeur plasmatique usuelle comprise entre 0 et 1 mg/dl. Une valeur > 3 mg/dl suggère fortement une inflammation systémique. Les concentrations comprises entre ces 2 seuils sont équivoques (ex. inflammation précoce, discrète ou en cours de résolution).
Les 3 maladies inflammatoires où ce marqueur se révèle particulièrement utile (dépistage, suivi et pronostic) sont : les polyarthrites, les méningites dysimmunitaires, et les pneumonies infectieuses.
Son intérêt est également rapporté dans le dépistage/suivi/pronostic d’infections bactériennes variées (pyomètre, pyélonéphrite, pyodermite, prostatite, leptospirose, ehrlichiose), de pancréatite aiguë, de parvovirose, d’infections parasitaires (piroplasmose, leishmaniose, dirofilariose, angiostrongylose), de processus dysimmunitaires (AHMI, MICI) ou de processus néoplasiques (lymphome).
Conditions de prélèvement :
Collecte par cystocentèse ou miction naturelle
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Le RPCU permet de quantifier/confirmer une protéinurie visible à la bandelette urinaire. Cette protéinurie peut être d’origine rénale (glomérulaire voire tubulaire) ou hémorragique/inflammatoire (ex. pyélonéphrite, cystite, lithiase, tumeur, etc.).
Le RPCU est donc interprété en fonction de l’examen microscopique de l’urine : un RPCU élevé sans inflammation/hématurie significative sera en faveur d’une atteinte rénale.
Une atteinte glomérulaire est suspectée lorsque le RPCU est > à 2 sur deux ou trois échantillons (en dehors de tout signe d’inflammation du tractus urinaire). Dans les atteintes tubulaires, le RPCU est moins élevé.
Exemple d’atteinte glomérulaire : glomérulonéphrite (infections vectorielles, leptospirose, lupus, pancréatite, MICI, néoplasie, Cushing, etc.) et autres glomérulopathies (amyloïdose, néphrites héréditaires, glomérulosclérose, etc.).
Interprétation du RPCU dans le cadre d’une maladie rénale chronique (IRIS) :
< 0,2 chez le chien/chat : non protéinurique
0,2-0,5 chez le chien et 0,2-0,4 chez le chat : protéinurie limite
> 0,5 chez le chien et > 0,4 chez le chat : protéinurique
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Dans toutes les études, chez le chat, l’augmentation de la concentration de SAA est plus précoce que celle des marqueurs traditionnels, tels que la numération leucocytaire ou la protidémie, et le retour aux valeurs initiales plus rapide après cessation de la réaction. L’intensité de l’augmentation est également le plus souvent plus forte que pour les autres marqueurs. Cette augmentation est en général de l’ordre de 5 à 10 fois la valeur de base, mais elle atteint parfois un facteur 100. Lorsque des marqueurs traditionnels comme la leucocytose ou la neutrophilie sont utilisés pour identifier un processus inflammatoire, entre 40 et 50 % des chats ne présentent aucune modification de ces variables lors d’un processus inflammatoire.
Les variations les plus fréquentes et les plus intenses sont observées lors d’infections ou d’inflammations, par exemple par le virus de l’immunodéficience féline (FIV) ou lors de péritonite infectieuse féline (PIF), mais aussi dans quelques rares cas de cancers ou d’hypoglycémie ou lors de chlamydiose. Une augmentation est également observée après des interventions chirurgicales, même simples, comme une castration ou une ovario-hystérectomie.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une augmentation de la SDMA indique une diminution du taux de filtration glomérulaire : atteinte rénale, pré-rénale (ex. déshydratation, choc), ou post-rénale.
La SDMA augmente en moyenne après 40% de perte de fonction rénale (versus 75% environ pour la créatinine), soit 9 et 14 mois avant la créatinine chez les chiens et les chats atteints de maladie rénale chronique, respectivement. Contrairement à la créatinine, sa valeur est peu ou pas affectée par des facteurs extra-rénaux (ex. masse musculaire).
Une atteinte rénale est typiquement confirmée lors de perte concomitante de la capacité à concentrer l’urine (densité urinaire < 1.030 chez le chien et < 1.035 chez le chat) et de RPCU augmenté (en l’absence d’inflammation/hématurie à l’urologie).
La valeur seuil de référence de la SDMA classiquement retenue pour détecter une atteinte du débit de filtration glomérulaire est de 14 µg/dl (sensibilité de 90 % pour la détection d’une baisse du DFG de plus de 40 %). Cependant, la spécificité est médiocre (environ 50 %). Une étude montre qu’une valeur seuil modifiée de 18 µg/dl autorise une sensibilité toujours importante (90 %) mais augmente la spécificité à 83 %.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La concentration des sels biliaires peut augmenter en raison d’une diminution de la masse fonctionnelle hépatique (ex. hépatite chronique, nécrose, néoplasme diffus), un shunt vasculaire (ex. SPS congénital ou acquis) ou une cholestase. La sévérité et la nature précise de l’atteinte hépatobiliaire ne peuvent être précisées par la seule mesure des sels biliaires.
Chez le chien/chat, il est recommandé de doser la concentration pré (à jeun) et post-prandiale (2h après un repas riche en graisses). La valeur basale est parfois supérieure à la valeur post-prandiale (contraction spontanée de la vésicule biliaire avant le repas).
Il s’agit d’un paramètre sensible pour mettre en évidence une dysfonction hépatobiliaire (sensibilité proche de 80%), en particulier un shunt porto-systémique (sensibilité proche de 100% dans ce cas). Ce paramètre est également très spécifique (proche de 100%).
Note : la fiabilité de ce paramètre est proche de l’ammonium, avec le net avantage d’être bien plus stable (l’ammonium doit être mesuré sur un plasma rapidement séparé, non hémolysé, non exposé à l’air, et maintenu à 4°C jusqu’à la mesure (<4 h)).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec) rapidement séparé
Conservation et stabilité : envoi sous 24h si possible réfrigéré sinon congélation à – 20°C (stable plusieurs jours/semaines)
Interprétation :
La troponine I est un biomarqueur cardiaque lésionnel qui peut être augmenté dans les situations suivantes :
– Myocardite chez le chien (critère diagnostique majeur si la TnI est > 1000 ng/l)
– Maladie valvulaire mitrale dégénérative du chien
– Dyspnée d’origine cardiaque (TnI > 660 ng/l) versus respiratoire (TnI < 240 ng/l) chez le chat
– Cardiopathie congénitale du chien telle que la sténose aortique ou pulmonaire
– Cardiomyopathie dilatée du chien (probable si TnI > 210 ng/l, peu probable si TnI < 60 ng/l)
– Cardiomyopathie arythmogène du ventricule droit du Boxer (probable si TnI > 110 ng/l, peu probable si TnI < 90 ng/l)
– Cardiomyopathie hypertrophique du chat (probable si TnI > 163 ng/l, peu probable si TnI < 60 ng/l)
– Souffle cardiaque asymptomatique
– Épanchement péricardique chez le chien, notamment en cas de péricardite et d’hémangiosarcome
– Maladies parasitaires telles qu’une dirofilariose ou une leishmaniose viscérale (avec cardiopathie)
– Traumatisme thoracique chez le chien et le chat
– Cardiotoxicité à la doxorubicine (excellent marqueur = nettement plus sensible et précoce que l’échocardiographie)
La TnI présente une grande variabilité biologique. Lors de dépistage ou de suivi d’animaux cardiaques, une différence de plus de 100-130% entre 2 mesures est considérée comme significative.
De nombreuses affections extracardiaques peuvent être associées à une élévation des biomarqueurs cardiaques : hyperthyroïdie, Cushing, Addison, azotémie, hypertension artérielle, anémie sévère, inflammations sévères (ex. pancréatite), lymphome, épilepsie, affections respiratoires, causes physiologiques (chiens âgés ou chats > 5kg).
Endocrinologie
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une diminution des folates indique la présence d’une malabsortion intestinale chronique (duodénum).
Une prolifération bactérienne intestinale peut au contraire faire augmenter les folates.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une valeur d’aldostérone élevée est compatible avec un hyperaldostéronisme primaire, lorsque la présentation clinique et que les examens complémentaires supportent cette hypothèse : ex. visualisation d’une masse surrénalienne à l’imagerie médicale, faiblesse généralisée progressive associée à une hypokaliémie souvent sévère (K+ < 3 mmol/l), hypertension.
L’hyperaldostéronisme primaire se définit par une hypersécrétion autonome d’aldostérone par la zone glomérulée de la corticosurrénale (aldostéronome), majoritairement liée à la présence d’une tumeur unilatérale (adénome ou adénocarcinome).
Il est important d’exclure un hyperaldostéronisme secondaire (fonctionnel) regroupant l’ensemble des maladies qui active le système rénine-angiotensine-aldostérone, soit par réduction du volume sanguin (ex. maladie cardiaque), soit par hypersécrétion de rénine (ex. maladie rénale chronique), soit via une stimulation directe du SRAA par des tissus extrarénaux (ex. tissu adipeux des animaux obèses).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
3 prélèvements : T0 (avant dexaméthasone), T1 (après 4h) et T2 (après 8h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
– Diagnostic du syndrome de Cushing par freination à la dexaméthasone faible dose (0.01 mg/kg en IV) :
Une valeur de cortisolémie à 8 heures non ou insuffisamment freinée (> 27.59 nmol/l) est en faveur d’un syndrome de Cushing (surtout si la cortisolémie à 4h et à 8h est > à 50% de la cortisolémie à T0). Il est important d’exclure les causes de faux positifs (ex. inflammation, diabète, tumeur).
La sensibilité de ce test est réputée plus haute que le test de stimulation à l’ACTH (proche de 95% donc très peu de faux négatifs).
Lorsque la valeur de cortisolémie à 4 heures est peu ou pas freinée (> 27.59 nmol/l), malgré une valeur basse à 8 heures (< 27.59 nmol/l), le résultat est considéré équivoque. Un syndrome de Cushing est possible, et il est recommandé de répéter le test après quelques semaines.
– Origine du Cushing hypophysaire vs surrénalienne par freination à la dexaméthasone faible dose (0.01 mg/kg en IV) :
Une freination partielle (cortisolémie à 4h et/ou à 8h < 50% de la valeur à T0) est compatible avec une origine hypophysaire. Cette déduction est possible chez 2/3 des chiens avec un hypercorticisme hypophysaire.
Une freination insuffisante ou absente à 4h et à 8h ne permet pas de conclure sur l’origine hypophysaire vs surrénalienne. Un test de freination à la dexaméthasone forte dose (0.1 mg/kg en IV) peut alors être tenté : 1/4 des chiens avec un hypercorticisme hypophysaire ne montreront pas non plus de freination suffisante avec ce test (à 4h et à 8h) et l’origine de la maladie ne pourra être précisée.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
2 prélèvements : T0 (avant ACTH), T1 (après 1h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Diagnostic du syndrome de Cushing avec stimulation à l’ACTH (5 µg/kg IV ou IM – mesure à T0 et T+1h) :
Une valeur de cortisolémie post-simulation > 580 nmol/l est en faveur d’un syndrome de Cushing. Un résultat entre 500 et 580 nmol/l peut être considéré comme équivoque.
Une valeur de cortisolémie post-simulation > 680 nmol/l permet de conclure à un syndrome de Cushing avec une probabilité de 95% (100% si > 720 nmol/l).
Il est important d’exclure les causes de faux positifs (ex. inflammation, diabète, tumeur).
Certains animaux avec un syndrome de Cushing ne sont pas détectés par ce test (20-30% voire plus en cas d’hypercorticisme surrénalien essentiellement observé chez les grandes races).
Ce test permet aussi de déceler un syndrome de Cushing iatrogène (cortisolémie effondrée).
En cas de résultat douteux ou négatif, avec une présentation clinique très évocatrice, un test de freination à la dexaméthasone faible dose peut être réalisé.
Remarque : il est important de ne pas administrer d’autres glucocorticoïdes que la dexaméthasone avant le test (interférence avec la cortisolémie endogène mesurée). Si c’est le cas, ils doivent être arrêtés graduellement au moins 36-48h avant.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
2 prélèvements : T0 (avant ACTH), T1 (après 1h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Diagnostic du syndrome d’Addison avec stimulation à l’ACTH (5 µg/kg IV ou IM – mesure à T0 et T+1h) :
Une cortisolémie basale > 55 nmol/l exclut un syndrome d’Addison à 100%.
Une cortisolémie basale effondrée et une absence de réponse à la stimulation (T0 et T+1h < 55 nmol/l) sont en faveur d’un syndrome d’Addison. Un syndrome de Cushing iatrogène ou un traitement de syndrome de Cushing (surdosage) peuvent aussi engendrer de tels résultats.
Remarque : il est important de ne pas administrer d’autres glucocorticoïdes que la dexaméthasone avant le test (interférence avec la cortisolémie endogène mesurée). Si c’est le cas, ils doivent être arrêtés graduellement au moins 36-48h avant.
La mesure du ratio cortisol/ACTH (sans stimulation à l’ACTH) permet aussi d’identifier les chiens en hypocorticisme si sa valeur est effondrée.
Les anomalies biochimiques typiques sont une hyperkaliémie et une hyponatrémie. Toutefois, certains animaux peuvent présenter un syndrome d’Addison atypique avec une déficience en glucocorticoïde seule qui ne s’accompagne pas d’anomalie électrolytique (évolution possible vers un hypocorticisme classique avec une déficience conjointe en minéralocorticoïde).
Si des changements électrolytiques sont constatés, un ratio Na/K < 24 est 100% spécifique d’un syndrome d’Addison.
Les anomalies hématologiques souvent associées sont : une anémie non régénérative (Ht 20-35%), une hémoconcentration, une lymphocytose, une éosinophilie, et une absence de formule de stress. Si une lymphocytose est présente, son intensité permet de prédire la probabilité d’un syndrome d’Addison : 90% de spécificité si la lymphocytose est > 2.2 x 10^3 /µl (presque 100% de spécificité au-delà de 5.0 x 10^3 /µl).
Les autres anomalies biologiques souvent observées sont une azotémie, une densité urinaire basse, une hypoglycémie, une hyperphosphatémie, etc.
Le suivi biologique du traitement repose sur la mesure régulière du Na et K (avec correction des autres anomalies hémato-biochimiques).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
2 prélèvements : T0 (avant ACTH), T1 (après 1h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Suivi de traitement au Trilostane avec stimulation à l’ACTH (5 µg/kg IV ou IM – mesure à T0 et T+1h) : 10 j après le début du traitement, à 1 mois, à 3 mois, puis tous les 3-6 mois.
– Après 10 j de traitement :
Suivi clinique, urée, créatinine, ionogramme et test de stimulation à l’ACTH pour écarter un hypocorticisme iatrogène.
1/ Si aucun signe d’hypocorticisme (avec cortisolémie > 40 nmol/l) : poursuivre le traitement sans modifier les doses durant le premier mois.
2/ Si présence de signes d’hypocorticisme (ou si cortisolémie < 40 nmol/l) : diminuer ou interrompre le traitement. Un nouveau contrôle est recommandé 10 j après la reprise du traitement (faibles doses).
– Après 1 mois de traitement :
1/ Valeur souhaitée 3 à 5h après le traitement : entre 40 et 150 nmol/l avec une bonne réponse clinique.
2/ Si la valeur est entre 40 et 150 nmol/l avec des signes d’hypercorticisme, un traitement biquotidien (matin/soir) peut être envisagé afin d’augmenter la durée d’action du Trilostane, suivi d’un contrôle 10 j plus tard.
3/ Si la valeur est < 40 nmol/l sans signes d’hypocorticisme, il est recommandé de suspendre le traitement durant 5-7 j, puis de diminuer les doses (ex. 25-50%), et de contrôler 10 j plus tard.
4/ Si la valeur est < 40 nmol/l avec des signes cliniques d’hypocorticisme, il est recommandé d’interrompre le traitement durant 2-4 semaines (+ dosage des électrolytes et créatinine plasmatiques). Un contrôle est recommandé 10 j après la reprise du traitement (faibles doses).
5/ Si la valeur est < 40 nmol/l avec des signes cliniques d’hypercorticisme, il est recommandé de revoir le diagnostic initial ou de rechercher une comorbidité pouvant expliquer la persistance des signes cliniques.
6/ Si la valeur est > 150 nmol/l sans signes d’hypercorticisme, le traitement peut être poursuivi sans changement (un contrôle clinique régulier est néanmoins recommandé).
7/ Si la valeur est > 150 nmol/l avec des signes d’hypercorticisme (PU/PD et polyphagie), une augmentation des doses (ex. 25-50%) peut être envisagée suivie d’un contrôle 10 j plus tard.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Eviter la période post-prandiale
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
L’IGF-1 est un polypeptide synthétisé par le foie, analogue de l’insuline, dont les principaux effets sont l’augmentation de la synthèse protéique, la prolifération et la différenciation cellulaire, la chondrogénèse et la croissance.
– Une valeur augmentée sera en faveur d’une acromégalie (à l’origine d’une insulinorésistance, en particulier chez le chat).
– Une valeur diminuée est compatible avec un nanisme hypophysaire.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Eviter la période post-prandiale
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une valeur élevée d’insuline (> 30 µUI/ml) avec une hypoglycémie (nécessitant parfois un jeûne préalable) est compatible avec un insulinome. Un insulinome est peu probable lorsque la valeur est basse (< 20 µUI/ml). Pour augmenter la performance du test, plusieurs mesures (jusqu’à 4) peuvent être réalisées à jeun. Il est important que le test soit réalisé à distance de toute administration de glucose, repas ou médicament hyperglycémiant (dont les stéroïdes).
L’hémolyse peut affecter le dosage (fausse diminution).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
– Cycle :
Pro-oestrus et oestrus : 50 à 200 pmol/l ; metoestrus : 35 pmol/l; anoestrus : < 35 pmol/l
– Gestation :
Valeur basale à basse pendant les 6 premières semaines, augmentation en fin de gestation
– Pathologies :
Valeur élevée associée à certaines tumeurs ovariennes (comme certaines tumeurs testiculaires)
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
– Femelle stérilisée ou en anoestrus : < 35 pmol/L
– Oestrus ou fin de dioestrus : 50 à 150 pmol/L
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
– Cycle :
Pro-oestrus : environ 2 ng/ml
Oestrus : 4 à 10 ng/ml
Ovulation : 8 à 10 ng/ml
Metoestrus : > 15 ng/ml (et diminution progressive pendant 10 semaines si non gestante)
Anoestrus : < 1 ng/ml
Mise bas imminente : < 2ng/ml
– Gestation :
Pas de différence notoire entre la progestéronémie d’une chienne gestante et celle d’une chienne en metoestrus (mais chute brutale de la progestérone en fin de gestation).
– Rémanence ovarienne :
1er prélèvement dès l’apparition des pseudo-chaleurs, injection d’hCG (Chlorulon, 50 UI/kg, IM) et 2ème prélèvement 7-10 jours plus tard (valeur élevée si positif).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
– Anoestrus : < 1 ng/ml
– Ovulation et met-dioestrus : > 3 ng/ml
Conditions de prélèvement :
Collecte par cystocentèse ou miction naturelle. Il est recommandé de faire récolter l’urine à la maison pour limiter le stress (et au moins 2 jours après la visite chez le vétérinaire).
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Un syndrome de Cushing peut être exclu lorsque la valeur du RCCU est inférieure à 20.0 x 10^-6. Au-delà de cette valeur, il est très difficile de conclure (nombreux faux positifs, ex. diabète). Néanmoins, un syndrome de Cushing est très probable si le RCCU est > 100 x 10^-6.
Un test de freination à la dexaméthasone faible dose ou un test de stimulation à l’ACTH peut être envisagé, si votre suspicion clinique persiste.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
1/ Une valeur élevée de T4 libre permet généralement de confirmer une hyperthyroïdie. Dans quelques cas (+/- 5% des chats), la T4 libre peut être augmentée avec des pathologies extra-thyroïdiennes.
2/ Une valeur » normale-haute » de T4 libre ne permet pas d’exclure une hyperthyroïdie si la présentation clinique est évocatrice. La T4 libre reste dans les normes (hautes) chez environ 15% des chats hyperthyroïdiens.
Ceci peut s’expliquer par une forme débutante ou légère d’hyperthyroïdie. Une comorbidité (ex. diabète, IRC, MICI) et certaines médications (corticoïdes, TMS, AINS) peuvent aussi abaisser la T4 libre. Un suivi est alors recommandé après traitement éventuel (si possible) des comorbidités, et/ou interruption des médications pouvant abaisser la T4 libre.
NOTE : sur des situations équivoques, il a été montré que la TSH canine (cTSH) peut être mesurée : une valeur effondrée pourra renforcer la suspicion d’une hyperthyroïdie (30% des chats euthyroïdiens ont toutefois une TSH non mesurable).
3/ Une valeur » normale-basse » ou diminuée permet généralement d’exclure une hyperthyroïdie. Certaines pathologies extra-thyroïdiennes (ex. diabète, IRC, MICI) ou médications (corticoïdes, TMS, AINS) peuvent causer une chute de la T4 libre (sans engendrer d’hypothyroïdie clinique).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
1/ Une valeur normale de T4 libre et de TSH permettent d’écarter une hypothyroïdie.
2/ Une valeur diminuée de T4 libre et une valeur élevée de TSH permettent de diagnostiquer une hypothyroïdie. Dans de rares cas, le TMS (voire le phénobarbital et une maladie extra-thyroïdienne) peuvent entraîner les mêmes variations sur la T4/TSH.
3/ Une valeur diminuée de T4 libre et une valeur normale de TSH ne sont pas en faveur d’une hypothyroïdie. La T4 libre diminuée peut être associée à d’autres pathologies extra-thyroïdiennes (endocriniennes ou inflammatoires par exemple) ou à certaines médiations (ex. corticoïdes, AINS, phénobarbital, TMS). Chez certaines races, la T4 peut également être physiologiquement plus basse (Greyhounds, Irish Wolfhounds, Sloughis, Salukis, etc.).
Il faut toutefois noter que 30% des chiens hypothyroïdiens peuvent avoir une TSH dans les normes. Un suivi est alors recommandé si la suspicion clinique persiste.
4/ Une valeur normale de T4 libre et une valeur augmentée de TSH peuvent s’observer dans de rares situations : hypothyroïdie débutante ou subclinique, effet rebond après l’arrêt d’une médication « suppressive » (ex. corticoïdes, AINS, etc.) ou après une maladie non-thyroïdienne, interférence avec des anticorps anti-T4 surestimant le dosage de la T4 libre (< 2% des chiens hypothyroïdiens). Un suivi est alors recommandé si la suspicion clinique persiste.
5/ Dans de rares cas, une valeur élevée de T4 libre peut s’observer (en dehors d’une conséquence iatrogène) : interférence avec des anticorps anti-T4 surestimant le dosage de la T4 libre (< 2% des chiens hypothyroïdiens) ou carcinome thyroïdien sécrétant de la T4 (10% de ces tumeurs sont sécrétantes).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Un suivi est recommandé 3 semaines après le début du traitement, puis tous les 3-6 mois. La valeur attendue se situe entre 15 et 35 pmol/l (mesure à n’importe quel moment de la journée indépendante de la prise du médicament).
Certains effets toxiques directs peuvent s’observer durant les 3 premiers mois : une dermatite cervico-faciale, des vomissements/diarrhée/anorexie, une hépatotoxicité, myélotoxicité, une myasthénie grave.
Il est important surveiller la fonction rénale tout au long du traitement.
Le pronostic est globalement moins bon lorsqu’une azotémie est déjà présente au moment du diagnostic de l’hyperthyroïdie.
L’hyperthyroïdie peut masquer une maladie rénale chronique, qui peut être révélée par la mise en place du traitement (dans 15-25% des cas). Il est toutefois recommandé de traiter l’hyperthyroïdie (également dommageable pour les reins), même chez des chats en stade II « stable » de MRC (IRIS). L’azotémie peut progresser légèrement suite au traitement, sans impact clinique et pronostique significatif.
Si la fonction rénale se détériore, le traitement de l’hyperthyroïdie pourra être ajusté.
Dans tous les cas, une hypothyroïdie iatrogène prolongée doit être évitée (facteur pronostique négatif). Chez des chats azotémiques avec une T4 libre basse, un surdosage peut être confirmé par une valeur élevée de cTSH.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Un suivi est recommandé 4-8 semaines après le début du traitement puis 1-2 fois par an selon la réponse clinique.
Valeur de T4 libre attendue :
– Avant traitement > 10 pmol/l
– 3 à 5 heures après traitement > 17 pmol/l (et < 40 pmol/l)
Si la TSH est mesurée, une valeur normale-basse devrait être observée.
Remarque : les chiens semblent particulièrement résistants aux effets toxiques d’une supplémentation en T4. En cas de surdosage (T4 libre > 90 pmol/l), les signes de toxicité disparaissent quelques jours après l’arrêt ou la diminution du traitement.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Chien mâle entier (sain) : valeur basale 5 – 15 nmol/L et > 25 nmol/L après stimulation à l’hCG (Chorulon MSD, 50 UI/kg IM)
Chat mâle entier (sain) : valeur basale 15 – 25 nmol/L et > 45 nmol/L après stimulation à l’hCG (Chorulon MSD, 50 UI/kg IM)
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La sensibilité du dosage de TLI est proche de 100% en dessous du seuil de 3,5 µg/L et la spécificité est proche de 100% au-delà du seuil de 5 µg/L. Pour les valeurs intermédiaires situées entre 3,5 et 5 µg/L, il peut s’agir d’une IPE débutante ou subclinique qui nécessite une nouvelle mesure (à jeun – 3 semaines plus tard), notamment chez les races prédisposées (Bergers Allemands et races apparentées, Chow Chow, Eurasier, Terre Neuve).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
1/ TSH normale : hypothyroïdie peu probable. Cependant, jusqu’à 30% des chiens hypothyroïdiens peuvent avoir une TSH dans les normes.
2/ TSH élevée : hypothyroïdie très probable. Dans certains cas, une maladie extra-thyroïdienne ou certaines médications (ex. TMS ou phénobarbital) peuvent causer une augmentation de la TSH sans hypothyroïdie. Pour diminuer ce risque de faux positifs associé à une mesure isolée de la TSH (7-18% selon les études), il est recommandé de doser conjointement la T4 libre/totale (< 2% de faux positifs dans ce cas).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une baisse de la vitamine B12 peut être due à une malabsorption chronique de la vitamine B12, secondaire à un dommage pancréatique, gastrique ou iléale (dont tumeurs et MICI).
La prolifération de certaines bactéries intestinales peut aussi causer une baisse de la vitamine B12 (surconsommation).
Médicaments
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Le moment importe peu par rapport à la prise du médicament
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Lorsque le bromure est associé au phénobarbital, des bromémies comprises entre 0,7 et 2,5 g/L ont été prouvées comme efficaces alors qu’utilisé seul, il faut parfois atteindre des concentrations jusqu’à 3 g/L.
Du fait de sa demi-vie longue (de plus de 15 à 20 jours), la prise de sang de contrôle de la bromémie peut être effectuée n’importe quand dans la journée en évitant toutefois de la réaliser dans les deux heures suivant la prise de manière à éviter un pic de concentration.
Le premier contrôle de bromémie est conseillé 6 à 12 semaines après la mise en place du traitement puis sur une base annuelle à moins que l’animal présente plus de 3 crises avant le prochain contrôle ou si des effets secondaires (sédation principalement) sont suspectés.
Les effets secondaires rapportés avec l’utilisation du bromure sont une ataxie des membres postérieurs, une faiblesse et une baisse de vigilance. Ces effets sont le plus souvent observés quand la bromémie dépasse 3 g/L. Le bromure étant éliminé par voie rénale, cette concentration peut plus facilement être atteinte chez des animaux présentant une maladie rénale chronique.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Il est recommandé de réaliser la prise de sang 8 à 12 heures après la prise de digoxine.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
L’intervalle des concentrations recherchées est étroit et compris entre 0,8 et 1,2 ng/mL (des effets secondaires peuvent être observés dès ces concentrations, en particulier si l’animal est hypokaliémique ou insuffisant rénal).
Le premier contrôle de la digoxinémie est recommandé 3 à 5 jours après la mise en place du traitement puis tous les 3 à 6 mois.
Les signes de toxicité sont digestifs (anorexie, diarrhée, vomissement, nausées), neurologiques (somnolence), et cardiaques (tachycardies ventriculaires et/ ou extrasystoles ventriculaires isolées notamment).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement 3-5 h après le traitement
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Les valeurs attendues au cours du traitement se situent entre 15 et 40 mg/L, toutefois, la majorité des animaux sont bien stabilisés avec des valeurs comprises entre 10 et 20 mg/L.
Fréquence du suivi thérapeutique : 3 semaines après le début du traitement (équilibre thérapeutique atteint) puis tous les 6 mois. En cas de changement de la dose thérapeutique (persistance des crises ou à l’inverse présence d’effets indésirables/toxiques), un contrôle 3 semaines plus tard est recommandé.
A des doses thérapeutiques classiques, peuvent survenir des effets indésirables comme une polyphagie accompagnée d’une polydipsie et d’une polyurie, un effet hypnotique et une faiblesse des membres postérieurs avec ataxie. Ces troubles régressent en une à deux semaines. Lorsqu’ils sont marqués, une diminution de la dose est à envisager.
Une intoxication hépatique peut survenir à 45 mg/L (à explorer par une biochimie hépatique avec une mesure des sels biliaires à jeun et 1 heure après le repas). L’administration du phénobarbital peut aussi avoir un effet délétère sur la moelle osseuse : une pancytopénie ou, plus souvent, une neutropénie d’origine immunotoxicologique. Ces deux effets régressent après l’arrêt de l’administration de phénobarbital.
Urologie
Oxalate de calcium :
La formation des calculs d’oxalate de calcium dépend de nombreux facteurs, notamment : hypercalciurie, diurèse faible (concentration élevée en solutés), prédisposition génétique.
Si une hypercalcémie est présente, il est important d’en déterminer la cause.
En l’absence d’hypercalcémie, il est recommandé de favoriser la diurèse, diminuer la calciurie et au besoin d’alcaliniser l’urine, en veillant à apporter une alimentation réduite en calcium, sodium et oxalate.
En cas d’obstructions récidivantes, la cystotomie ou l’hydropulsion peuvent être envisagées.
Struvite :
La formation des struvites est favorisée par une infection urinaire, un pH urinaire alcalin et un régime alimentaire déséquilibré. Il existe également une prédisposition génétique.
Parmi les mesures diététiques correctrices, un apport réduit en magnésium, phosphore et protéines est recommandé. Les urines peuvent être acidifiées (méthionine).
En cas d’échec de traitement médical, l’hydropulsion ou la cystotomie peuvent être envisagées.
Cystine :
Ce type de calcul est plus fréquent chez le mâle et lors d’acidurie. Certaines races sont également prédisposées (ex. Teckel).
Un régime pauvre en protéine et alcalinisant est généralement recommandé. Si besoin, les urines peuvent être alcalinisées.
La synthèse de cystine peut être inhibée par la tiopronine (ACADIONE) et la pénicillamine peut permettre de dissoudre les calculs.
En cas de récidives : cystotomie ou hydropulsion recommandée.
Phosphate de calcium :
Ce type de calcul est rarement pur (souvent mixte avec prédominance de struvite ou d’oxalate de calcium). Les causes favorisantes incluent une hypercalciurie, une hyperphosphaturie et une urine alcaline (ex. secondaire à une infection urinaire).
Un apport réduit en calcium, protéines et vitamines D est recommandé, tout en favorisant la diurèse.
En cas d’obstructions récidivantes, la cystotomie ou l’hydropulsion peuvent être envisagées.
Urates :
Certaines races sont prédisposées, sans autre pathologie concomitante : Dalmatien, Bulldog anglais notamment. Certains chats sains peuvent aussi présenter ce type de calcul.
Ils peuvent aussi être observés en cas de shunt vasculaire portosystémique et de maladies hépatiques sévères.
Outre le traitement d’une éventuelle atteinte hépatique, un apport réduit en purine (éviter les abats) et en protéines est recommandé, tout en favorisant la diurèse et un pH urinaire plutôt alcalin. L’ Allopurinol peut être utilisé chez le Dalmatien.
En cas d’obstructions récidivantes, la cystotomie ou l’hydropulsion peuvent être envisagées.
Comment ?
– La cystocentèse échoguidée permet d’obtenir un prélèvement de très bonne qualité. Le principal avantage est de prévenir la contamination des urines par les voies urinaires et génitales, donc la réalisation de prélèvements stériles pour l’examen bactériologique.
La cystocentèse est, en revanche, fréquemment à l’origine d’une contamination sanguine des urines prélevées.
– La récolte par miction spontanée permet le plus souvent d’obtenir un prélèvement de qualité. Les urines sont recueillies dans un contenant propre du type barquette à usage unique. Les urines sont idéalement récoltées après un lavage des voies uro-génitales externes de l’animal (eau du robinet sans savon/antiseptique) et une éventuelle coupe ou tonte des poils dépassant des voies externes. Les premiers jets doivent, si possible, être exclus.
– Le sondage ne doit pas être utilisé pour la réalisation d’une simple analyse d’urine chez le chien ou le chat. Les risques traumatique et infectieux pour l’animal sont en effet importants. Le prélèvement est généralement de qualité inférieure à celui qui est obtenu par les autres méthodes (nombreux débris, cellules épithéliales, hémodilution, contamination bactérienne, voire fongique, etc.).
Où ?
Le RPCU mesuré sur des urines obtenues à la clinique est supérieure à la valeur mesurée sur celles récoltées au domicile de l’animal (stress). Cette surestimation est plus forte chez les chiens protéinuriques versus non protéinuriques. La valeur du rapport cortisol sur créatinine urinaires (RCCU) est également augmentée sur des urines récoltées à la clinique, pouvant amener à de faux positifs.
Quand ?
La prise d’un repas récent est une cause d’alcalinisation des urines. La densité urinaire est plus élevée sur les premières urines du matin que sur un autre prélèvement pendant la journée. La capacité ou non d’un animal à concentrer ses urines est donc mieux évaluée sur les urines du matin. Pour le RCCU, il est recommandé de récolter les urines du matin 2 à 3 jours de suite pour limiter l’effet des variations journalières et au moins 2 jours après une visite chez un vétérinaire pour limiter l’effet du stress. En revanche, le RPCU n’est pas significativement affecté par le moment de collecte de l’urine.
Conservation :
4°C (cristallisation d’oxalates de calcium néanmoins favorisée) et à l’abri de la lumière jusqu’à l’envoi.
Densité urinaire
La densité urinaire, qui est une estimation de l’osmolalité urinaire, permet d’évaluer la capacité du rein à concentrer ou à diluer les urines. L’interprétation des résultats de la bandelette urinaire ou des constituants du sédiment urinaire nécessite de connaître la densité urinaire de l’animal.
Les premières urines du matin sont à privilégier pour la mesure de la densité urinaire.
Une densité urinaire basse observée de manière récurrente chez un animal normalement hydraté ou encore la production d’urines diluées chez un animal déshydraté constituent des situations anormales, nécessitant une exploration avec en hypothèse sous-jacente l’ensemble des causes de polyuro-polydipsie. Une densité urinaire > 1.030 chez le chien et > 1.035 chez le chat suggèrent une absence de maladie rénale (sauf si débutante).

pH
L’intervalle des valeurs physiologiques du pH chez le chien et le chat s’étend de 4,5 à 8,5.
Le pH urinaire est très variable et dépend, entre autres, du statut acidobasique de l’animal, de son régime alimentaire, de la prise d’un repas récent, d’une éventuelle infection du tractus urinaire. Les régimes plus riches en protéines sont associés à un pH urinaire plus acide, c’est pourquoi les carnivores ont un pH urinaire généralement plus bas que les herbivores. La prise récente d’un repas amène en revanche à une légère alcalinisation passagère des urines chez les carnivores. La contamination des urines par les désinfectants ou détergents courants (par exemple, l’eau de Javel) peut entraîner un résultat erroné (alcalinurie artéfactuelle). Les infections urinaires à bactéries uréase positives ou un stockage prolongé des urines à l’air libre sont des processus alcalinisants.
Protéines
Lors d’alcalinurie marquée, une plage protéines positive peut être artéfactuelle. De même, une contamination des urines par des détergents (ammoniums quaternaires) peut être à l’origine de faux positifs.
Une protéinurie peut être prérénale, rénale, ou postrénale. La protéinurie prérénale est liée au passage de petites protéines au travers du filtre glomérulaire normal (ex. protéines de Bence-Jones lors de myélome multiple, myoglobine lors de rhabdomyolyse, hémoglobine lors d’hémolyse intravaculaire). La bandelette identifie surtout l’albumine et peu les globulines. Les deux principales causes pathologiques de réaction positive de la plage protéines sont donc les protéinuries rénale et postrénale. Une protéinurie rénale est liée à un dysfonctionnement glomérulaire et/ou tubulaire. Une protéinurie postrénale résulte d’une atteinte située sur le tractus uro-génital, sans atteinte des néphrons. Cela peut survenir lors d’une inflammation du tractus uro-génital, d’une hématurie ou d’une spermaturie (faible protéinurie). Lors de protéinurie à la bandelette, il convient donc d’écarter les faux positifs, puis de déterminer si la protéinurie est d’origine rénale ou postrénale, à l’aide de l’examen du culot de centrifugation. Plusieurs études ont montré la très grande sensibilité des bandelettes urinaires pour la protéinurie (excepté pour la protéinurie prérénale), mais aussi sa faible spécificité chez le chien, et encore plus chez le chat.
L’interprétation du résultat doit être interprété en fonction de la valeur de la densité urinaire. Chez le chien :
– Pour toute densité urinaire, un résultat de 0 est généralement négatif et pour une densité urinaire supérieure ou égale à 1,030, un résultat de 1+ à la bandelette, avec un culot inactif, doit être considéré comme négatif et n’appelle pas à la réalisation d’un rapport de la protéinurie sur la créatininurie (RPCU) pour quantifier la protéinurie.
– Pour une densité urinaire inférieure ou égale à 1,012, un résultat de 1+ avec un culot inactif doit être considéré comme potentiellement positif et amener à la réalisation d’un RPCU pour confirmer et quantifier ou exclure la protéinurie.
– Pour toute densité urinaire, un résultat supérieur ou égal à 2+ avec un culot inactif est considéré positif et doit mener à la réalisation d’un RPCU.
Glucose
Lors de glucosurie détectée à la bandelette, celle-ci doit être interprétée conjointement à la glycémie de l’animal, les mesures respectives étant réalisées au même moment. La glucosurie peut être associée à une hyperglycémie, traduisant simplement le dépassement de la capacité de réabsorption tubulaire rénale du glucose (environ 1,8 g/l chez le chien et 2,6 à 3 g/l chez le chat). L’hyperglycémie peut être passagère et physiologique (stress, perfusion de glucose), persistante et pathologique (diabète sucré, hypercorticisme, pancréatite, phéochromocytome, acromégalie, sepsis, etc.) ou bien secondaire à une autre cause (toxique [éthylène glycol] ou médicamenteuse [corticoïdes, adrénaline, progestérone, etc.]). Si la glucosurie n’est pas associée à une hyperglycémie, elle signe une atteinte tubulaire rénale. Le diagnostic différentiel comprend alors le syndrome de Fanconi, une tubulopathie acquise (leptospirose chez le chien par exemple, toxicité médicamenteuse) ou bien une glucosurie rénale primaire (basenji, chien d’élan norvégien, shetland).
Bilirubine
La plage bilirubine des bandelettes urinaires réagit préférentiellement avec la bilirubine conjuguée, plus soluble que la bilirubine non conjuguée. La bilirubine conjuguée est instable et photosensible, pouvant être à l’origine de faux négatifs. Une bilirubinurie, comme une hyperbilirubinémie, peut avoir lieu en cas de production augmentée (hémolyse), d’insuffisance hépatique ou de cholestase intra- ou posthépatique. Il a également été démontré chez le chien une capacité des cellules rénales à conjuguer, puis à excréter la bilirubine, c’est pourquoi une bilirubinurie est fréquemment rapportée chez des animaux sains. Une bilirubinurie pathologique peut précéder une hyperbilirubinémie, mais de façon non systématique, et il est possible d’obtenir un test négatif à la bandelette chez des chiens en hyperbilirubinémie. Chez le chat, la bilirubinurie est toujours pathologique, y compris dans des urines très concentrées.
Activité peroxydasique (sang)
Une plage de la bandelette détecte l’activité peroxydasique de l’hème de l’hémoglobine et de la myoglobine principalement. Ce test est très sensible, donc efficace même sur des urines macroscopiquement normales (non colorées).
Le résultat est positif en cas d’hématurie “vraie” (sang en nature dans les urines), d’hémoglobinurie (en cas d’hémolyse in vivo ou in vitro) et de myoglobinurie. L’examen du culot de centrifugation permet de discriminer entre une hématurie et une pigmenturie (hémoglobinurie ou myoglobinurie). Le reste de l’examen biologique de l’animal (numération et formule sanguines [NF], créatine kinase [CK]) permet de déterminer si une hémolyse ou une lésion musculaire est à l’origine de la pigmenturie. La couleur du plasma est également une indication : un plasma clair suggère une myoglobinurie ou une hématurie, alors qu’un plasma rosé ou rouge évoque une hémolyse intravasculaire. Enfin, lors de faible hématurie (par exemple, liée à une contamination au moment du prélèvement par cystocentèse), il est possible que les hématies, peu nombreuses, soient lysées pendant la centrifugation du culot. Ainsi un résultat positif de la plage activité peroxydasique peut être obtenu, avec des urines non colorées, en l’absence d’hématies au culot et d’anomalie au bilan biologique suggérant une hémolyse ou une rhabdomyolyse.
Corps cétoniques
En conditions physiologiques, le résultat de la bandelette doit être négatif. Les corps cétoniques sont des composants volatils, c’est pourquoi l’analyse de la bandelette doit être réalisée immédiatement après le prélèvement. Les corps cétoniques sont produits à la suite d’une dérive du métabolisme énergétique des cellules, délaissant la glycolyse au profit d’une lipolyse accrue.
Chez les carnivores domestiques, cela survient dans deux situations :
– Un diabète sucré mal contrôlé (acido-cétosique)
– Une anorexie prolongée
Interprétation du dénombrement sur gélose en fonction de la méthode de collecte :
– Cystocentèse : significatif si > 10^3 CFU /ml
– Cathétérisme : significatif si > 10^4 CFU /ml
– Miction naturelle : significatif si > 10^5 CFU /ml
Remarques générales sur les bactéries identifiées :
– Les principales bactéries d’intérêt clinique sont : Escherichia coli, Staphylococcus intermedius, Proteus mirabilis, Enterococcus faecalis, Streptococcus du groupe G et Pseudomonas aeruginosa. Si une autre bactérie est isolée et/ou si plusieurs bactéries différentes sont présentes, une contamination du prélèvement doit être considérée.
– Certaines bactéries uréase-positives favorisent la formation de cristaux/urolithes de struvite : Proteus sp., Pseudomonas sp., Staphylococcus sp. et Klebsiella sp.
– Enterococcus (faecalis et faecium) est parfois isolé, la plupart du temps sans signification clinique, et disparaît sans nécessiter de traitement. Si une autre bactérie est présente, le traitement portera préférentiellement sur celle-ci, même si l’antibiogramme montre un profil multirésistant pour Enterococcus.
– L’usage d’antibiotiques ayant une bonne élimination urinaire est recommandé : ex. pénicilline, amoxicilline, TMS, quinolones.
Démarche thérapeutique lors d’infection urinaire :
Les causes favorisantes d’une infection urinaire incluent : lithiase, tumeur, obésité, maladie rénale, malformations congénitales, diabète sucré, syndrome de Cushing, corticothérapie, prostatite.
– En cas de cystite sporadique (animal en bonne santé, aucune comorbidité ou anomalie anatomique, < 3 épisodes en 12 mois) : 3-5 jours de traitement (ex. amoxicilline ou TMS) débuté si possible après les résultats de la culture bactérienne (AINS dans l’attente).
– En cas de cystite récurrente (> 3 épisodes en 12 mois ou > 2 épisodes en 6 mois) : recherche de comorbidités nécessaire, début de l’antibiothérapie si possible après les résultats de la culture bactérienne (AINS dans l’attente), 3-5 jours de traitement si réinfection par une nouvelle bactérie, 7-14 jours si infection répétée ou persistante avec la même bactérie. Changement d’antibiotique seulement en l’absence d’amélioration clinique et selon les résultats de l’antibiogramme (dans le cas d’une amélioration clinique, même si l’antibiogramme indique une résistance in vitro, le traitement peut être poursuivi). En cas de cystite récurrente, il faut rechercher une guérison clinique plutôt qu’une résolution biologique (la persistance d’une bactériurie subclinique peut être tolérée afin d’éviter une exposition excessive aux antibiotiques).
– Pyélonéphrite (fièvre, léthargie, PUPD, douleurs rénales, azotémie, neutrophilie, etc.) : traitement de 10-14 jours (ex. céfalexine, fluoroquinolones), à adapter selon l’antibiogramme
– Prostatite bactérienne (signes cliniques de cystite chez un mâle entier) : investigations complémentaires (imagerie, lavage, cytologie, etc.), traitement de 4-6 semaines (ex. TMS, quinolones – ou clindamycine/macrolides si sensibilité in vitro à l’antibiogramme) et castration recommandée.
Dans tous les cas de figure ci-dessus, un ECBU de contrôle est recommandé 1 semaine après l’arrêt du traitement.
Cas des bactériuries subcliniques (et sans pyurie) :
– Une bactériurie sans pyurie peut être associée à une contamination de l’échantillon (flore urogénitale externe, prélèvement non stérile, délai d’analyse prolongé).
– Une bactériurie subclinique (et sans pyurie) ne nécessite pas d’antibiothérapie, même si la bactérie est multirésistante. Environ 10% des chiens sains (davantage en cas d’obésité, diabète, Cushing, paralysie, immunosuppresseurs, …) et 20% des chats sains ont une bactériurie subclinique, sans augmentation du risque d’infection urinaire chez ces animaux.
– Si les signes cliniques sont en faveur d’une cystite, ou s’il existe un risque important d’infection ascendante, ou en présence d’une bactérie uréase-positive favorisant la formation de struvites (ex. Proteus, Pseudomonas, Staphylocoques), un traitement de 3-5 jours (ex. amoxicilline ou TMS) peut être réalisé, et adapté selon la réponse clinique et l’antibiogramme.
Erythrocytes
Une hématurie microscopique peut être d’origine iatrogène, liée au mode de prélèvement (cystocentèse ou sondage). Si le prélèvement est réalisé par miction spontanée, l’hématurie est toujours pathologique. Lorsqu’elle est pathologique, l’hématurie peut être de différentes origines, dont :
– les reins (potentiellement associée à la présence de cylindres hématiques)
– le bas appareil urinaire : calculs, inflammation, traumatisme, tumeur
– l’appareil génital : œstrus, maladie prostatique
– des troubles de l’hémostase
Leucocytes
La présence de leucocytes en quantité significative signe l’existence d’une inflammation, qu’elle soit primaire (infection du tractus urogénital) ou secondaire (calculs, traumatisme, tumeur, cyclophosphamide, etc.). Lors d’inflammation secondaire, des cristaux (phosphate ammoniaco-magnésien ou struvites, oxalates, etc.) ou des cellules tumorales, par exemple, peuvent être retrouvés selon la cause.
Cellules épithéliales
Deux types de cellules épithéliales sont distingués :
– Les cellules squameuses, présentes uniquement sur le tiers distal de l’urètre et en regard des voies génitales
– Les cellules urothéliales (urètre proximal, vessie, uretères, bassinet, tubules rénaux)
Ces cellules peuvent être présentes normalement dans les prélèvements réalisés par sondage urinaire.Elles sont aussi observées lors :
– d’inflammation
– de processus néoplasique (carcinome transitionnel), et sont alors associées à des atypies cytonucléaires
– de chimiothérapie au cyclophosphamide
Cylindres
Les cylindres sont des éléments d’aspect rectangulaire qui épousent la forme des tubules rénaux.Il en existe plusieurs types :
– les cylindres hyalins. Ils peuvent être retrouvés chez des individus sains (0 ou 1 par champ au grossissement × 400). Lorsqu’ils sont nombreux (plus de 2 par champ à × 400), ils sont le signe d’une atteinte rénale
– les cylindres granuleux sont constitués de matériel cellulaire dégradé. Ils sont toujours le signe d’une souffrance rénale (incluant la leptospirose). Cependant, l’absence de cylindres granuleux (ou hyalins) ne permet pas d’exclure la possibilité d’une atteinte rénale
– il existe aussi des cylindres érythrocytaires, graisseux ou encore leucocytaires, leur nom dépendant du contenu incorporé au sein de la matrice protéique
Cristaux
– Struvites
Ces cristaux se forment à pH basique ou neutre. Ils peuvent être retrouvés chez des animaux sains en faible quantité, chez des individus présentant des calculs et lors d’infection du tractus urinaire.
– Oxalate
Les cristaux d’oxalate se forment dans les urines neutres ou acides, et éventuellement dans les urines basiques. Ils sont parfois présents en faible nombre chez des animaux sains, mais, en quantité significative, ils sont possiblement associés à des calculs, retrouvés lors d’intoxication à l’éthylène glycol (hyperoxalurie avec surtout des monohydrates) ou d’hypercalciurie.
– Urates d’ammonium
Ils sont retrouvés fréquemment chez le dalmatien et les bouledogues anglais, et lors de maladies hépatiques ou de shunt porto-systémique.
– Bilirubine
Ils peuvent être physiologiques chez le chien, en faible quantité, et observés dans des urines très concentrées. Cependant, présents en quantité importante sur plusieurs analyses d’urines consécutives, ils sont le signe d’une hyperbilirubinurie avec une hyperbilirubinémie (hémolyse, atteinte hépatique, cholestase, etc.). Ils sont toujours pathologiques chez le chat.
– Cystine
Leur formation est toujours pathologique et survient chez des animaux atteints d’une anomalie congénitale caractérisée par un défaut de réabsorption tubulaire de la cystine (bulldog anglais, teckel, chihuahua, bull mastiff). Cependant, les animaux présentant une cystinurie ne développent pas tous des calculs de cystine.
Bactéries
La détection de bactéries dans les urines doit conduire à une suspicion d’infection du tractus urinaire si elles sont associées à des leucocytes. Cependant, le mode de prélèvement doit être pris en compte (contamination cutanée lors de miction spontanée ou de défaut d’asepsie). La bactériologie est l’examen de choix pour leur quantification, leur identification et la réalisation d’un antibiogramme.
Autres éléments
– Les globules gras sont fréquents et physiologiques chez le chat.
– Des spermatozoïdes sont parfois observés dans le sédiment urinaire de chiens et de chats mâles non castrés. Ils sont alors le signe d’une éjaculation rétrograde.
– Des contaminants sont également fréquemment observés, avec notamment des bulles d’air, des fibres végétales ou encore des grains de pollen.
Conditions de prélèvement :
Collecte par cystocentèse ou miction naturelle. Il est recommandé de faire récolter l’urine à la maison pour limiter le stress (et au moins 2 jours après la visite chez le vétérinaire).
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Un syndrome de Cushing peut être exclu lorsque la valeur du RCCU est inférieure à 20.0 x 10^-6. Au-delà de cette valeur, il est très difficile de conclure (nombreux faux positifs, ex. diabète). Néanmoins, un syndrome de Cushing est très probable si le RCCU est > 100 x 10^-6.
Un test de freination à la dexaméthasone faible dose ou un test de stimulation à l’ACTH peut être envisagé, si votre suspicion clinique persiste.
Conditions de prélèvement :
Collecte par cystocentèse ou miction naturelle. Le RPCU mesuré sur des urines obtenues à la clinique est supérieure à la valeur mesurée sur celles récoltées au domicile de l’animal (stress). Cette surestimation est plus forte chez les chiens protéinuriques versus non protéinuriques. En revanche, le moment de collecte dans la journée importe peu.
Conservation et stabilité (si envoi différé) : stable pendant 15 jours à +4 °C et 3 jours à température ambiante.
Interprétation :
Le RPCU permet de quantifier/confirmer une protéinurie visible à la bandelette urinaire. Cette protéinurie peut être d’origine rénale (glomérulaire voire tubulaire) ou hémorragique/inflammatoire (ex. pyélonéphrite, cystite, lithiase, tumeur, etc.).
Le RPCU est donc interprété en fonction de l’examen microscopique de l’urine : un RPCU élevé sans inflammation/hématurie significative sera en faveur d’une atteinte rénale.
Une atteinte glomérulaire est suspectée lorsque le RPCU est > à 2 sur deux ou trois échantillons (en dehors de tout signe d’inflammation du tractus urinaire). Dans les atteintes tubulaires, le RPCU est moins élevé.
Exemple d’atteinte glomérulaire : glomérulonéphrite (infections vectorielles, leptospirose, lupus, pancréatite, MICI, néoplasie, Cushing, etc.) et autres glomérulopathies (amyloïdose, néphrites héréditaires, glomérulosclérose, etc.).
Interprétation du RPCU dans le cadre d’une maladie rénale chronique (IRIS) :
< 0,2 chez le chien/chat : non protéinurique
0,2-0,5 chez le chien et 0,2-0,4 chez le chat : protéinurie limite
> 0,5 chez le chien et > 0,4 chez le chat : protéinurique

Infectiologie : prélèvement et interprétation
Bactériologie et mycologie
Remarques générales :
Les prélèvements liquides (ex. lavage, épanchement, pus) et solides (ex. biopsies, produits de grattage, etc.) peuvent être placés dans un pot stérile ou un tube sec (avec un fond de saline stérile pour les prélèvements solides). Ils sont maintenus réfrigérés jusqu’à l’envoi sous 24-48h.
Les écouvillons peuvent être laissés à T° ambiante et acheminés au laboratoire sous 3-5 jours. Il est préférable d’utiliser des écouvillons associés à des milieux de transport (type Amies ou Stuart). Ils sont fournis par le laboratoire VETODIAG.
Note : Il est également possible de verser un prélèvement liquide (ex. Lavage respiratoire, épanchement) dans le milieu de transport d’un écouvillon, ou de tremper l’écouvillon dans l’échantillon, afin d’assurer une bonne conservation du prélèvement.
Si l’animal est sous antibiotique(s)/antifongique(s), un arrêt du traitement minimum 48h avant le prélèvement (idéalement 8 jours) est recommandé.
Prélèvement cutané et auriculaire :
La désinfection de la surface cutanée sur le site de prélèvement est déconseillée car elle détruit les germes pathogènes autant que les contaminants (un flushage à la saline stérile peut-être réalisé si la zone semble particulièrement souillée).
– Vésicules : ponction/aspiration du liquide vésiculaire
– Ulcérations : grattage/écouvillon au fond de l’ulcère (en soulevant éventuellement les croûtes et autres débris de surface).
– Pustules : ouverture au scalpel stérile et grattage/écouvillon des parois
– Lésions auriculaires : écouvillonnage profond après avoir enlevé le cérumen superficiel
– Lésions cutanées profondes : il est recommandé de soumettre une biopsie dermique (excision de l’épiderme superficiel source de contamination).
Collections purulentes :
Lorsqu’un abcès est présent, il est préférable, après débridement chirurgical, de prélever un morceau de la paroi de l’abcès ou d’écouvillonner les parois.
Les collections purulentes de grandes cavités peuvent être aspirées (après préparation aseptique du site de ponction).
Prélèvement respiratoire :
Les lavages bronchoalvéolaires sous fibroscopie ou par voie transtrachéale permettent le diagnostic bactériologique ou mycologique des infections pulmonaires en veillant à éviter une contamination par la flore oropharyngée.
Prélèvement sinusal :
Seuls les prélèvements effectués par lavage des sinus ou des cornets nasaux, ou par biopsie, peuvent permettre d’isoler le germe pathogène.
L’ écouvillonnage des fosses nasales ne permettent généralement pas d’isoler le germe responsable (et flore contaminante).
Prélèvement intestinal :
Les affections intestinales d’origine bactérienne sont rares chez les carnivores, peu décrites et souvent controversées.
On recueille une noisette de selles dans un pot propre stérile ou non stérile, conservé à 4 °C et transporté rapidement.
Prélèvement oculaire :
Un raclage doux de la conjonctive et de la cornée en évitant les contaminations de la flore cutanée palpébrale permet de recueillir les sécrétions purulentes et d’isoler les germes responsables de conjonctivites et de kératites microbiennes.
Prélèvement urinaire :
Les urines doivent être recueillies de façon stérile soit par cystocentèse, soit par cathétérisme, et conservées immédiatement à 4°C jusqu’à l’envoi.
Les urines prélevées par palpation-pression et élimination des premiers jets seront probablement contaminées par la flore urétrale ou vaginale.
Prélèvement ostéoarticulaire :
Une biopsie osseuse ou une ponction de liquide articulaire permet de réaliser une culture bactérienne. L’écouvillonnage d’un trajet fistuleux peut aussi être réalisé.
Septicémie :
La réalisation d’hémocultures doit être envisagée dans les cas suivants chez les carnivores : endocardite, discospondylite et hyperthermie prolongée inexpliquée. Au moins trois prélèvements (flacons d’hémoculture fournis par le laboratoire) sur 48 h, si possible au moment des pics d’hyperthermie, sont réalisés.
Accès à l’ensemble du guide :
.
Accès direct aux principaux chapitres (chien et chat) :
- Cancérologie
- Cardiologie
- Chirurgie des tissus mous
- Chirurgie orthopédique
- Dermatologie
- Neurologie
- Odonto-stomatologie
- Ophtalmologie
- Pathologies digestives
- Pathologies reproduction
- Pathologies respiratoires
- Urgences et réanimation
- Uro-néphrologie
Cas particuliers :
Bactériologie vaginale et infertilité
La bactériologie vaginale doit être réservée aux femelles qui présentent des signes d’atteinte vaginale ou des antécédents d’infertilité.
Après plusieurs tentatives de saillies infructueuses, il est préférable de réaliser une bactériologie vaginale plutôt qu’une antibiothérapie systématique aux chaleurs suivantes. Si 60 % des chiennes saines présentent des bactéries dans le vagin antérieur et en arrière du col de l’utérus, elles sont 90 % à en abriter dans leur vagin postérieur. Parmi ces bactéries, les plus fréquentes sont E. Coli, Streptococcus sp., Staphylococcus sp., Proteus sp., Pasteurella multocida, Corynebacterium sp., etc. Des bactéries anaérobies sont aussi retrouvées (Lactobacillus sp., Bifidobacterium sp., Clostridium sp., Corynebacterium sp.).
Les mycoplasmes sont communément présents dans le vagin de chiennes n’ayant pas de troubles de la reproduction. Brucella canis est une bactérie toujours pathogène, non présente chez un animal sain et rarissime en France, qui provoque des avortements tardifs et précoces. Sauf dans le cas de Brucella, les bactéries rencontrées lors d’infections vaginales et/ou utérines sont les mêmes que celles de la flore physiologique. En effet, le vagin contient des micro-organismes opportunistes commensaux, mais qui peuvent se révéler pathogènes en cas d’altération des défenses de l’hôte (à la faveur des chaleurs ou d’une mise bas).
En cas de bactériologie vaginale chez une chienne saine, deux à quatre souches peuvent être retrouvées, mais jamais en quantité abondante. En effet, les populations s’autorégulent. La pathogénicité de la flore vaginale dépend donc avant tout de la concentration et du nombre d’espèces présentes. La prolifération d’une ou de deux souches, au-delà d’un seuil pathogène, peut être la cause d’infertilité ou de vaginites chroniques, même sans signes cliniques. En cas de prélèvement vaginal, une quantification ainsi qu’une identification sont donc indispensables. Cependant, si une culture pure est souvent considérée comme anormale, elle est observée aussi chez des chiennes saines. En cas de culture négative, rare mais possible, il est probable que la technique de prélèvement soit à revoir ou que la chienne ait été mise sous traitement antibiotique au préalable ou que le milieu de culture utilisé soit inadapté.
Conditions de prélèvement :
– Avec une brosse à dents à poils souples (neuve et dans un emballage unique), brosser énergiquement la zone atteinte (en périphérie) pendant 2-3 minutes jusqu’à remplir la brosse à dents avec les poils de l’animal. Envoyer la brosse à dents dans son sachet.
Ou
– Raclage à l’aide d’un scalpel mousse en périphérie de la zone atteinte et envoyer les poils/squames dans un tube sec, flacon ou sachet.
Ou
– Arracher des groupes de poils en périphérie de la zone atteinte (ex. pince hémostatique) et les envoyer dans un tube sec, flacon ou sachet. Cette dernière technique semble moins efficace.
La lésion à prélever est désinfectée à l’alcool à 70° (éponge inhibée pendant 30 secondes), l’alcool élimine la majorité des contaminants sans nuire aux dermatophytes.
Le prélèvement peut éventuellement être réalisé sous la lumière de Wood pour les teignes à Microsporum canis (mise en évidence que dans environ 50 % de cas).
Interprétation :
Le trichogramme (examen direct des poils, croûtes, squames) permet d’identifier les dermatophytes et les ectoparasites de surface. Cet examen, peu sensible, ne permet pas d’exclure une dermatophytose s’il est négatif.
Une culture fongique (voire une PCR) est alors recommandée : en général, une incubation contrôlée à 27-30 °C permet d’obtenir une réponse dans un délai de moins de deux semaines. L’identification des fongi est principalement réalisée par spectromètre de masse MALDI-TOF au laboratoire VETODIAG.
La biopsie cutanée peut aussi constituer un examen complémentaire utile pour orienter un diagnostic différentiel de dermatophytie. Cette biopsie est réalisée à l’aide d’un trépan à biopsie (type biopsy punch de diamètre 6 mm) au centre de la lésion.
Coprologie
Conditions de prélèvement :
Selles (ou écouvillon) conservées à l’obscurité et au frais (+ 4 °C), envoyées au laboratoire sous 24-48h.
Interprétation :
Les entérites primitives bactériennes sont rares chez les carnivores domestiques : Salmonella spp., Campylobacter jejuni, Clostridium difficile, Clostridium perfringens (et éventuellement Yersinia spp. et Shigella spp.) sont rapportés.
L’implication supposée de Clostridium spp. repose principalement sur la détection des toxines produites par ces bactéries (tests immunologiques réalisés au laboratoire).
Toutes ces bactéries étant également présentes chez des animaux sains (flore normale ou portage subclinique), la mise en place d’une antibiothérapie sera plutôt réservée aux entéropathies avec atteinte systémique (considérer le rapport bénéfice/risque en raison des résistances bactériennes et dérives de flore possibles).
Les situations où l’antibiothérapie est indiquée se limitent à :
1. Entérite aigue grave avec rupture de la barrière épithéliale et risque de bactériémie
2. Suspicion d’entérite primitive bactérienne (rare)
3. Entéropathie chronique répondant au métronidazole (entité non reconnue chez le chat)
4. Colite histiocytaire (jeunes boxers et bouledogues français) : antibiothérapie après confirmation histopathologique sur biopsies et antibiogramme du E. coli pariétal
Escherichia coli (avec les autres entérobactéries) et Enterococcus font partie de la flore bactérienne commensale (digestive ou environnementale) chez le chien et le chat. Une antibiothérapie sur ces germes n’est donc pas recommandée et pourrait de surcroît engendrer des résistances bactériennes ou une dérive de flore délétère.
Conditions de prélèvement :
Quantité minimale de 2 à 5 g (10 g pour la technique de Baermann visant à rechercher les larves de nématodes respiratoires) de selles fraîches et non souillées, récoltées idéalement en intra-rectal ou immédiatement après la défécation, et si possible 3 prélèvements sur 3 jours consécutifs. Les selles peuvent être conservées plusieurs jours dans un pot propre, à l’obscurité et au frais (+ 4 °C).
Interprétation :
Un résultat négatif ne permet pas d’exclure une parasitose (ex. excrétion intermittente, parasite peu prolifique ou période pré-patente longue).
Face à un résultat positif, un traitement est à mettre en place et ce quel que soit le nombre d’éléments parasitaires observés car il n’existe aucun lien entre la charge parasitaire fécale et l’intensité de la maladie. Lors de charge importante, on peut bien sûr conclure à un parasitisme élevé, mais l’inverse n’est pas forcément vrai.
Le cas de la coccidiose peut faire exception. En effet, la mise en évidence d’ookystes de coccidies chez l’adulte non immunodéprimé n’étant pas anormal, elle ne conduira pas systématiquement à une thérapie.
La sensibilité de la coproscopie n’est pas suffisante pour la recherche de Giardia sp., Cryptosporidium sp. et Tritrichomonas sp. (chat), un test PCR ou antigénique est alors recommandé pour compléter l’examen microscopique.
Revue des principaux parasites identifiés par coproscopie chez le chien et le chat
Source : PratiqueVet (2011) 46 : 33-37

PCR
Prélèvement :
Les prélèvements doivent être riches en cellules et le sang non centrifugé, de nombreux pathogènes étant intra-cellulaires. Les supports sont des tubes EDTA (pour le sang impérativement et éventuellement pour le liquide céphalorachidien, l’humeur aqueuse, l’urine ou les épanchements) ou des tubes secs (utilisables pour tous les prélèvements à l’exception du sang). Les tubes héparinés sont à proscrire dans tous les cas.
La fixation des tissus (formol, Bouin) altère les acides nucléiques ; les tissus frais ou congelés sont les prélèvements de choix.
Les écouvillons (rectaux, oropharyngés…) sont des écouvillons secs en coton et sans milieu de transport.
Les prélèvements oculaires peuvent être réalisés après instillation de fluorescéine.
Les prélèvements sont expédiés à température ambiante.
Il est préférable de prélever avant la mise sous traitement antibiotique, antiviral ou antiparasitaire et d’attendre au minimum 15 jours après l’arrêt du traitement pour le suivi post-thérapeutique (Ehrlichiose, hémobartonellose,…).
Interprétation :
Résultats négatifs et seuil de détection
Un résultat négatif signifie que l’agent infectieux recherché n’est pas présent ou en quantité inférieure au seuil de détection du test.
Résultats quantitatifs
Les méthodes quantitatives apportent souvent une information pertinente pour interpréter un résultat positif (Est-il significatif dans un contexte de suspicion clinique ? L’animal présente-t-il un danger pour un congénère ?). Elles sont particulièrement intéressantes si le portage asymptomatique est fréquent (ex. virus digestifs en collectivité). Par exemple, en collectivité, la plupart des chiots sont porteurs de parvovirus. Un résultat positif en PCR sur un écouvillon rectal ou même sur sang ne permet donc pas de conclure à une parvovirose. Seule la présence d’une charge virale importante est significative dans un contexte clinique. Le plus souvent, les charges virales sont très largement supérieures lors d’infection clinique aiguë (ex. parvovirus), mais ce n’est pas le cas pour les formes chroniques.
Détection possible d’agents infectieux non viables (ou ne pouvant être mis en culture)
Les traitements spécifiques et le système immunitaire (et certains facteurs pré-analytiques comme le délai d’analyse ou les conditions de conservation du prélèvement) participent à la destruction et à l’élimination des agents infectieux. La détection des acides nucléiques provenant d’organismes non viables (dont la culture serait difficile voire impossible) est possible mais reste limité dans le temps.
Résultat positif et interférence avec la vaccination
La PCR peut détecter une souche vaccinale dans les jours/semaines suivant l’injection d’un vaccin vivant (ex. parvovirus; charge virale généralement faible). En revanche, la présence d’anticorps d’origine maternelle, vaccinale ou post-infectieuse n’interfère pas avec le diagnostic PCR. Il est par exemple possible de dépister une infection par le FIV chez un chat né de mère séropositive.
PCR ou sérologie ?
En pratique, dans un contexte de diagnostic, la PCR sera généralement préférée dans les phases aiguës de l’infection, ou lorsque le contexte épidémiologique rend difficile l’interprétation d’une séropositivité (contexte d’enzootie, vaccination antérieure,…). La PCR offre aussi la possibilité d’identifier des porteurs asymptomatiques, ce qui peut être utilisé pour la prévention de transmission d’agents infectieux dans un contexte d’élevage.
La sérologie pourra être intéressante en phase plus chronique, et notamment si un traitement ayant pu éliminer l’agent pathogène a été mis en place. La sérologie sera également préférée si un échantillon contenant l’agent pathogène ne peut pas être obtenu. Dans un contexte d’épidémiosurveillance et de prévention, l’utilisation de tests sérologiques permet la réalisation de grandes études de séroprévalence.
Conditions de prélèvement :
Ecouvillon oro-nasopharyngé, LT/LBA (tube sec)
Conservation et stabilité (si envoi différé) : 48h à 72h
Interprétation :
Le virus de la grippe canine (CPiV) et l’adénovirus canin de type 2 (CAV2) sont les agents primaires de la toux de chenil et une surinfection bactérienne à Bordetella bronchiseptica demeure très fréquente.
L’Hespèsvirus canin est un agent secondaire, tout comme Mycoplasma sp. (ou encore Pasteurella et Pseudomonas sp.). Des coronavirus canins à tropisme respiratoire (CRCoV) ont récemment été envisagés comme cofacteurs de la maladie en Europe.
Conditions de prélèvement :
Lors de forme classique : écouvillonnage (ou cytobrosse) des muqueuses nasales/conjonctivales et cellules oro-pharyngées (amygdales lors de recherche de portage chronique asymptomatique), LBA.
Lors de forme virulente systémique : recherche sur sang, tissus ou organes atteints (peau, pancréas, rate, poumon, foie…).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré (sang, tissus ou organes)
Interprétation :
Il existe une forte prévalence du calicivirus dans l’espèce féline et une forte contagiosité. La variabilité génomique et antigénique (virus à ARN) est forte également : nombreuses souches circulantes de pouvoir pathogène variable, spectre de couverture vaccinale faillible, réinfections et portage oropharyngé persistant possibles.
L’interprétation de certains résultats positifs est délicate. Le lien entre les signes cliniques observés et la mise en évidence du calicivirus peut être difficile à établir, notamment en raison de la possibilité de portage oropharyngé chronique asymptomatique (surtout chez les chats hébergés en collectivité). Après infection, la plupart des chats éliminent le virus en moins de 30 jours, mais certains excrètent le virus pendant plusieurs années.
Conditions de prélèvement :
Ecouvillon conjonctival
Conservation et stabilité (si envoi différé) : 48h à 72h
Interprétation :
Chlamydophila felis est probablement le premier agent de conjonctivite bactérienne chez le chat.
La conjonctivite est le plus souvent unilatérale au départ pour devenir bilatérale en 5 à 7 jours. Un chémosis est presque constant. Une atteinte respiratoire sans atteinte conjonctivale n’est pas en faveur d’une atteinte par C. felis. Il n’existe pas d’atteinte associée de la cornée. Les symptômes conjonctivaux cessent en général au bout de deux mois (infection chronique possible).
La détection de la bactérie peut s’effectuée par cytologie d’un frottis conjonctival dans les premiers jours après l’infection (sensibilité < 50%) ou par PCR.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Ce type d’infection est surtout documenté chez les jeunes chiots de 2 à 3 mois, en élevage.
Les symptômes digestifs sont généralement modérés. Toutefois, il existe des situations où ces infections peuvent se révéler fatales. Pour les infections par le CCoV, il est décrit depuis 2005 l’existence de souches appelées pantropiques. Dans ce cas, l’infection par le CCoV ne se limite plus au tractus intestinal mais diffuse dans différents organes jusqu’aux poumons.
Une infection conjointe par le parvovirus est fréquente.
Le diagnostic se fait par RT-qPCR sur écouvillon rectal.
Conditions de prélèvement :
Sang total, épanchement, LCR, humeur aqueuse (tube EDTA)
Biopsies non formolées placées dans un tube sec ou dans un pot (rein, foie, poumon, NL mésentérique, etc.)
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Si un épanchement est présent, une PCR sur le liquide peut être réalisée (sensibilité de 80% et spécificité de 90-100%). En pratique, une charge virale forte dans l’épanchement, associée à l’ensemble des éléments cliniques et biologiques, permet de conclure à une PIF.
Avec une présentation neurologique ou oculaire, une PCR peut aussi être réalisée sur le LCR ou l’humeur aqueuse (sensibilité moyenne et spécificité > 95%). La PCR dans le sang, la rate, les noeuds lymphatiques et la moelle osseuse peut être positive chez des chats sains (charges souvent faibles dans ce cas).
En cas de doute sur l’interprétation d’un résultat positif, il peut être intéressant de réaliser en parallèle une PCR quantitative sur écouvillon rectal. Les animaux malades n’excrétant que peu ou pas de virus, une charge rectale faible ou un résultat négatif associé à la présence de virus dans un épanchement, du LCS ou même du sang constitue un critère diagnostique supplémentaire. Inversement, une charge rectale élevée doit conduire à reconsidérer l’hypothèse de PIF.
Le diagnostic de certitude reste histopathologique (immunohistochimie).
Conditions de prélèvement :
Sang total EDTA, NL, MO, rate, LCR
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PCR est la technique de choix pour le diagnostic de la phase aiguë de la maladie. L’examen est réalisé à partir du sang périphérique prélevé sur EDTA.
De l’ADN de ces agents pathogènes peut aussi être retrouvé sur des prélèvements de rate ou de moelle osseuse chez le Chien lors de la phase chronique, mais aussi sur des animaux ayant guéri de la maladie (porteurs sains).
Tout traitement anti-infectieux (tétracycline, quinolones, imidocarbe) peut entraîner une négativation plus ou moins rapide et durable de la PCR : un résultat négatif devra donc être interprété avec précaution sur un animal ayant reçu ce type de traitement.
La PCR est plus sensible que l’examen direct du frottis sanguin. Un résultat positif peut être obtenu 6 à 8 jours avant et 3 jours après l’apparition des morulas dans le sang (cas d’Anaplasma phagocytophilum).
Conditions de prélèvement :
Sang total EDTA, LCR, MO, écouvillon oro-nasopharyngé, organes.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La RT-PCR peut être réalisée en première intention ou en seconde intention pour confirmer un résultat positif obtenu par un test antigénique (ceux-ci ayant une valeur prédictive positive peu élevée en raison de la prévalence faible de la maladie dans la population générale).
Compte tenu de la possibilité d’infection régressive avec virémie transitoire (élimination ou possible portage latent et réactivation ultérieure du virus), un contrôle (PCR ou test antigénique) est recommandé quelques mois après un premier test positif.
Si une exposition récente ne peut être exclue, un résultat négatif doit être confirmé par un test de contrôle minimum 30 jours après le test initial.
Conditions de prélèvement :
Sang total EDTA, LCR, MO, écouvillon oro-nasopharyngé, organes.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La RT-PCR peut être réalisée en première intention ou à la suite d’un test sérologique positif. En effet, si le test sérologique est positif, chez un animal asymptomatique ou qui a peu de risques d’avoir été exposé, il est recommandé de le confirmer ultérieurement par la réalisation d’une PCR ou d’un second test sérologique (technique différente si possible). Il existe des faux-négatifs en PCR, liés à la variabilité de la séquence virale recherchée (virus ARN) ou à une faible charge circulante.
Chez un chaton, compte tenu de la présence d’anticorps maternels, des faux-positifs aux tests sérologiques sont possibles pendant les 4 voire les 6 premiers mois. La PCR peut alors être utilisée pour préciser le statut de l’animal.
En cas de suspicion d’infection récente, la PCR peut être privilégiée (le délai d’apparition des anticorps pouvant être > 60 jours).
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
La contamination se fait par voie orale à partir de kystes de Giardia présents dans l’environnement, sur le pelage de l’animal, ou des aliments et eau souillés par des matières fécales contaminées. Ces kystes peuvent survivre plusieurs semaines dans l’environnement et sont directement infectants. Après ingestion, le kyste libère deux trophozoïtes qui adhèrent aux entérocytes, à l’origine de signes cliniques. La période prépatente, de l’ingestion de kystes à l’élimination de nouveaux kystes dans les fèces, est de 5 à 7 jours, avec des animaux pouvant excréter des kystes pendant plusieurs semaines à plusieurs mois en l’absence de traitement.
Pour la recherche du parasite, des selles sont prélevées sur 2 à 3 jours afin d’augmenter la sensibilité du test. Le risque de faux négatifs ne doit pas être négligé du fait de l’excrétion intermittente.
Chez les animaux asymptomatiques ayant un test positif pour Giardia, un traitement n’est généralement pas conseillé, tout en n’excluant pas le risque zoonotique qui devrait être discuté avec le propriétaire. Seuls les animaux diagnostiqués positifs pour Giardia et présentant des troubles cliniques compatibles avec une giardiose recevront un traitement.
Pour le suivi du traitement, la coproscopie est à privilégier, car les autres tests peuvent donner des résultats positifs quelques jours (PCR) à plusieurs semaines (tests antigéniques) après l’élimination du parasite.
Conditions de prélèvement :
Selon la présentation clinique : écouvillon (ou cytobrosse) naso-oro-nasopharyngé, kérato-conjonctival, LBA, génital (vaginal/prépucial ou sperme dans un tube sec), organes (rein, rate, foie, poumon non fixés en cas de mortalité néonatale).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Ce virus présente un tropisme respiratoire, génital et nerveux.
Le virus peut être transmis par voie oronasale, vénérienne ou transplacentaire.
Chez le chien adulte, la faible réplication du virus dans l’organisme rend les signes cliniques le plus souvent très discrets (atteinte respiratoire haute légère ou absente, inflammation des muqueuses génitales, avec ou sans vésicules, possible mais peu fréquente). Le virus entre ensuite dans une phase de latence où le génome viral s’intègre dans le noyau des cellules à longue durée de vie (neurones notamment). Tout chien contaminé doit donc être considéré comme infecté à vie. Une réactivation du virus est possible en cas de stress ou d’immunodépression. Chez la chienne gravide, une infection ou une réactivation est suivie d’une atteinte des annexes fœtales.
Chez le chiot de moins de trois semaines, une réplication rapide dans les tissus lymphoïdes est observée avec une forme souvent fatale de la maladie (signes digestifs, respiratoires voire nerveux). La seule protection efficace repose sur l’absorption des anticorps colostraux, qui diminue fortement l’expression des symptômes et la mortalité des chiots.
Les signes d’appel dans un élevage (où la séroprévalence y est élevée +/- 60-80%) sont des troubles de la reproduction, une mortalité importante des chiots de moins de trois semaines.
Un résultat positif en PCR indique la présence du virus dans l’organisme. Celle-ci ne préjuge pas de l’activité virale, sauf sur des chiots morts.
Conditions de prélèvement :
Ecouvillonnage (ou cytobrosse) des cellules oro-pharyngées (amygdales lors de recherche de portage chronique asymptomatique), des muqueuses nasales/conjonctivales (cornée en cas de kératite) et LBA.
Lors d’avortements ou de troubles de la reproduction : cellules vaginales et/ou placentaires, cellules prépuciales et/ou sperme, organes des fœtus.
Conservation et stabilité (si envoi différé) : 48h à 72h – réfrigéré
Interprétation :
Il existe une forte prévalence et une forte contagiosité de l’herpesvirus dans l’espèce féline, avec une fréquence élevée de forme respiratoire et/ou oculaire aiguë, alors que les formes cliniques aiguës atypiques ou chroniques sont plus rares (pneumonie, dermatite, ulcères cutanés et/ou buccaux, atteinte nerveuse, rhinite chronique, etc.).
L’interprétation d’un résultat positif est délicate en raison de la possibilité de portage latent (surtout chez les chats hébergés en collectivité) : les phases de réactivation virales peuvent être associées à une excrétion asymptomatique du virus sans lien avec les manifestations cliniques observées. Inversement, l’obtention d’un résultat négatif est fréquente et ne permet pas de conclure que le virus n’est pas responsable dans certaines formes chroniques (les ganglions nerveux sont le principal site de latence).
Conditions de prélèvement :
Noeud lymphatique, moelle osseuse, peau/conjonctive (biopsies non formolées, cytoponctions, ou raclages cutanés déposés dans un tube sec ou EDTA)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PCR possède une très bonne sensibilité et une spécificité de 100 %. Cependant, la sensibilité de cet examen dépend du tissu testé (par ordre décroissant : nœud lymphatique ou moelle osseuse, peau, conjonctive, sang, ce dernier présentant une sensibilité proche de 0). Une PCR positive n’est toutefois pas synonyme de maladie et le résultat doit toujours être interprété dans le contexte clinique.
Conditions de prélèvement :
Sang total EDTA, urine (EDTA, tube sec ou flacon), organes (foie, reins, rate des avortons)
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
La PCR est un bon moyen d’établir un diagnostic précoce lorsqu’elle est pratiquée sur du sang (sur EDTA) ou de l’urine, mais doit être réalisée dans les 10 jours suivant le début de l’infection car elle peut se négativer rapidement. La recherche sur un mélange sang et urine est préférable. Un pool d’urines prélevées à différents temps peut augmenter les chances de détection.
Seul un résultat positif peut être interprété avec certitude. La PCR identifie uniquement l’espèce pathogène Leptospira interrogans et non le sérovar en cause.
De nombreux faux négatifs existent, aussi bien dans le sang que dans l’urine, en raison de l’intermittence de la leptospirémie et de la leptospirurie. Une recherche sérologiques des IgM (immunochromatographie), les premières semaines post-infection, ou des IgG (MAT, ELISA), à partir de 3-4 semaines post-infection (2 sérologies à 2 semaines d’intervalle idéalement), peut être intéressante en cas de PCR négative.
Conditions de prélèvement :
Sang total EDTA, moelle osseuse
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Mycoplasma haemofelis est le plus pathogène des hémoplasmes félins et peut être à l’origine d’une anémie hémolytique (M. haemominutum et M. turicensis sont les 2 autres espèces rapportées chez le chat mais qui n’induisent pas d’anémie sauf en cas de coinfection par les rétrovirus félins).
M. haemofelis est observé au frottis sanguin dans moins de 50 % des cas lors des phases aiguës de la maladie. La PCR est donc le test de choix : beaucoup plus sensible, elle permet une reconnaissance différentielle des espèces de mycoplasme et l’évaluation de la charge parasitaire.
La PCR doit être envisagée avant tout traitement antibiotique. Elle peut rester positive après traitement (faible charge dans ce cas). Une recherche conjointe du FeLV et FIV est recommandée (pronostic et décision thérapeutique).
Conditions de prélèvement :
Avec un écouvillon sec ou une cytobrosse : cellules conjonctivales, cellules cornéennes en cas de kératite, cellules naso-oro-pharyngées (amygdales pour détecter un portage asymptomatique chronique), LBA.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PCR est indiquée chez les chats présentant des signes cliniques de conjonctivite, kératite ulcéreuse, rhinosinusite, syndrome coryza, et pneumonie.
Pour une interprétation du résultat dans un contexte clinique, il faut tenir compte d’un taux de portage qui peut atteindre 20% dans des prélèvements oro-pharyngés (amygdales) en collectivité chez les animaux asymptomatiques.
Conditions de prélèvement :
– Exploration de troubles de la reproduction : Organes fœtaux ou du chiot décédé sur tube sec (poumon, foie, rein, rate), placenta sur tube sec, écouvillon vaginal de la femelle.
– Détermination de statut des animaux asymptomatiques : prélèvement oro-pharyngé, conjonctival, vaginal ou préputial (écouvillons), sperme (tube sec).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Dans un contexte de troubles de la gestation, d’avortement ou de mortinatalité, la présence de virus est compatible avec des troubles de la reproduction à parvovirus type 1 (virus minute). Chez un chien adulte asymptomatique, la présence du virus témoigne d’une excrétion. L’animal est probablement contagieux.
A noter que les charges virales sont souvent faibles y compris chez les animaux symptomatiques et que le virus minute peut ne pas être le seul agent infectieux responsable des troubles observés.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
En général, les chiens atteints d’une gastro-entérite secondaire au parvovirus présentent une charge virale forte dans les selles. Une leucopénie, une lymphopénie et une hypoalbuminémie sont des facteurs pronostiques péjoratifs. Une augmentation de la protéine C-réactive (CRP) est associée à la mortalité. Le taux de mortalité est également plus élevé chez certaines races comme le Dobermann, le Rottweiler, le Pit-bull et le Berger allemand.
Les co-infections sont nombreuses et peuvent être recherchées : ex. Coronavirus, Salmonella sp., Escherichia Coli, Campylobacter sp., Clostridium perfringens, Clostridium difficile, Toxocara sp., Giardia sp., Isospora sp.
Le chien peut être porteur asymptomatique, notamment en collectivité. Une interférence avec la vaccination (vaccin vivant atténué) est possible : le virus peut être détecté dans les selles (charge souvent faible) durant quelques semaines/mois après la vaccination.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
La panleucopénie ou parvovirose féline est une virose fréquente et très contagieuse dont les manifestations sont dominées par des troubles digestifs associés à une leucopénie marquée, chez les chatons plus de 4 semaines. Elle est mortelle dans environ la moitié des cas, ce qui justifie un diagnostic rapide par PCR ou tests antigéniques.
Lors de contamination in utero durant le dernier tiers de la gestation ou dans les deux semaines suivant la naissance, le virus peut provoquer une atrophie cérébelleuse à l’origine d’ataxie chez les chatons. La contamination in utero pendant les deux premiers tiers de la gestation est à l’origine d’avortement.
L’administration récente (< 2-3 semaines) d’un vaccin atténué peut induire une réaction faussement positive ; il faut dans ce cas préférer la PCR quantitative qui permet d’évaluer la charge virale fécale généralement plus élevée lors d’infection.
Conditions de prélèvement :
Sang total EDTA, moelle osseuse
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Babesia canis, est l’agent étiologique principal des babésioses canines en France et en Europe.
Babesia vogeli présente dans les pays du pourtour méditerranéen est considérée comme moins pathogène. Si l’anémie hémolytique est décrite, les complications sont plus rares.
De rares cas d’infection à Babesia gibsoni ont été rapportés en Europe, responsables de formes cliniques souvent plus graves et/ou de rechutes, et une mauvaise réponse aux traitements piroplasmicides classiques.
Sur un frottis, la non-observation des piroplasmes ne permet pas de conclure à l’absence d’infection (défaut de sensibilité). La PCR sur sang total est alors recommandée, notamment en cas de suspicion d’infection par une petite forme de Babesia (plus difficile à observer au frottis sanguin), d’échecs thérapeutiques ou d’atteintes graves. Un deuxième épisode d’hémolyse une semaine à 10 jours après un diagnostic attesté de piroplasmose doit conduire à envisager une complication d’anémie immunitaire secondaire et à la réalisation d’un test de Coombs direct (en plus de l’examen du frottis sanguin).
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
L’infection à Tritrichomonas fœtus chez le Chat est associée à des diarrhées chroniques ou récidivantes avec une colite, les animaux jeunes (< 1an), stressés ou immunodéprimés étant plus susceptibles de développer la maladie.
Les Trichomonadidés sont des parasites fragiles dans le milieu extérieur, ceux-ci ne s’enkystant pas dans l’environnement. La transmission est donc directe, par voie féco-orale (ingestion de trophozoïtes émis dans les fèces de chats infectés). La forte densité d’animaux dans les refuges et les élevages augmente donc les risques d’infection. Certains chats peuvent être porteurs asymptomatiques.
La sensibilité de la coproscopie est faible, la PCR est à privilégier.
Sérologie
Prélèvement :
Les prélèvements peuvent être du sérum ou éventuellement du plasma hépariné (éviter l’EDTA qui peut interférer avec certaines techniques ELISA), ou d’autres liquides biologiques comme le LCS ou l’humeur aqueuse. Ils peuvent être conservés une semaine à +4 °C ou 6 mois à -20 °C et être expédiés à température ambiante.
Interprétation :
Les anticorps sont détectés généralement pendant plusieurs mois après l’exposition, ce qui offre une grande fenêtre d’exploration dans le temps. Toutefois, il s’agit aussi d’un désavantage : un individu peut parfois demeurer séropositif très longtemps après le contact avec l’agent pathogène (plusieurs mois voire > 1 an), rendant l’interprétation d’un résultat délicate : la présence de ces anticorps indique-t-elle que l’agent pathogène est présent ? Oui, dans le cas où après exposition, l’agent pathogène n’est pas éliminé (cas du FIV), mais pas forcément dans le cas contraire. Puisque la sérologie ne documente qu’une exposition à un agent pathogène, un résultat positif doit être interprété avec prudence, l’exposition à cet agent ne signifiant pas nécessairement maladie. La réponse immunitaire de l’hôte au contact de l’agent pathogène peut conduire à son élimination sans que l’individu ne présente de signes cliniques.
Effectuer une cinétique d’anticorps (soit deux mesures à 2-3 semaines d’intervalle) peut aider à déterminer si l’exposition est récente ou non : la mise en évidence d’une augmentation significative (généralement x 2 à x 4) du titre indique un contact récent avec l’agent pathogène. Cela n’a d’intérêt toutefois que si les signes cliniques apparaissent en phase aiguë d’infection. La sérologie manque souvent de sensibilité en début de maladie et un contrôle sérologique 2 semaines environ après un premier résultat négatif peut être indiqué pour mettre en évidence une séroconversion, notamment si le premier échantillon a été obtenu peu de temps après l’apparition des symptômes.
Autre limite du test sérologique : l’interférence par les anticorps d’origine vaccinale ou maternelle. Cette problématique est à l’origine de difficultés d’interprétation de résultats chez des animaux vaccinés contre la leptospirose par exemple.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Une sérologie coronavirus négative rend l’hypothèse d’une PIF peu probable (10% de faux négatif notamment chez des chats avec une forme humide avancée), en revanche, un titrage sérologique élevé (ex. 1/1600 et au-delà) sera très suggestif de la maladie si la suspicion clinique est forte. Une valeur sérologique intermédiaire ne permettra pas de conclure.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Ehrlichia canis et Anaplasma phagocytophilum :
Les anticorps sont détectables 8 jours après l’exposition initiale et 2 à 5 jours après l’apparition des morulas en circulation.
Un test négatif ne peut pas exclure une infection, en particulier dans sa phase débutante (1 ère semaine), mais aussi lors de phase chronique évoluée. Un test positif signe une exposition à l’infection qui peut être ancienne, même avec un titre élevé. Un titre en anticorps multiplié par 4 entre 2 sérums prélevés à 1 ou 2 semaines d’intervalle suggère une infection active.
Des réactions croisées sont possibles entre A. phagocytophilum et A. platys, agent de la thrombopénie cyclique infectieuse canine, et dans une moindre mesure entre A. phagocytophilum et E. canis.
Conditions de prélèvement :
Sang total, plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 24 à 48h à T° ambiante, 7 jours si réfrigéré
Interprétation :
Ce test met en évidence l’antigène p27 en circulation (protéine de la nucléocapside virale) : détection hautement sensible et spécifique de l’antigénémie (qui s’installe dans les 30 jours suivant l’exposition chez la plupart des animaux).
Un résultat antigénique positif, chez un animal asymptomatique ou présentant peu de risque d’avoir été infecté, doit être confirmé ultérieurement (la diminution de la prévalence du FeLV augmente le risque de faux-positif +/-20%) par la réalisation d’une PCR ou d’un second test antigénique (technique différente si possible).
Compte tenu de la possibilité d’infection régressive avec virémie transitoire (élimination ou possible portage latent et réactivation ultérieure du virus), un contrôle de l’antigénémie est aussi à prévoir quelques mois après le premier test positif.
Si une exposition récente ne peut être exclue, un résultat négatif doit être confirmé par un test de contrôle minimum 30 jours après le test initial (ou une PCR plus précocement).
Il n’y a pas d’interférence avec la vaccination sauf si le prélèvement est fait immédiatement après l’injection.
Conditions de prélèvement :
Sang total, plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 24 à 48h à T° ambiante, 7 jours si réfrigéré
Interprétation :
Ce test met en évidence les anticorps dirigés contre des protéines virales, avec une très haute sensibilité et spécificité, malgré un risque de faux-négatifs en phase aiguë d’infection (anticorps produits dans les 60 jours post-infection pour la grande majorité des chats).
Si le résultat est positif, chez un animal asymptomatique ou qui a peu de risques d’avoir été exposé, il est recommandé de le confirmer ultérieurement par la réalisation d’une PCR ou d’un second test sérologique (technique différente si possible).
Chez un chaton, compte tenu de la présence d’anticorps maternels, des faux-positifs sont possibles pendant les 4 voire les 6 premiers mois. La PCR peut alors être utilisée pour préciser le statut de l’animal. Un résultat négatif est généralement fiable compte tenu de la faible prévalence de l’infection et de l’excellente sensibilité des tests. Toutefois, si une exposition récente au virus est suspectée, il est conseillé de répéter le test 60 jours plus tard (délai d’apparition des anticorps), ou éventuellement d’utiliser la PCR.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La prévalence sérologique est plus importante que la prévalence clinique, et seule une faible proportion de chiens développent une leishmaniose clinique (5 à 10 %).
Diagnostic de la Leishmaniose :
– Titrage supérieur au seuil (d’au moins deux dilutions) : résultat positif traduisant une forte réponse immunitaire et confirmant le diagnostic.
– Titrage égal ou proche du seuil (par ex. supérieur d’une dilution) : résultat douteux traduisant une situation potentiellement en évolution.
– Titrage en-dessous du seuil : résultat négatif ou taux faible d’anticorps traduisant une situation stable (infection contrôlée). Une infection précoce n’est toutefois pas exclue.
Une cytologie (myélogramme, adénogramme voire lésion cutanée) ou une PCR (mêmes prélèvements) peuvent aussi être réalisées.
Suivi de la Leishmaniose :
– L’augmentation d’au moins deux dilutions du titrage en anticorps peut traduire une rechute ou une évolution péjorative de la maladie.
– Le maintien du titrage au cours du temps (même après un traitement spécifique) n’a pas de signification particulière.
– La diminution du titrage, le plus souvent associée à une amélioration clinique et une restauration progressive éventuelle des modifications biologiques, est plutôt de bon pronostic.
La cytologie et la PCR peuvent aussi être utiles pour détecter une rechute.

D’après Le Point Vétérinaire / Avril 2016 / N° 364
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Les IgM (immunochromatographie) augmentent dès la 1ère semaine avec un pic à 2-3 semaines post-infection. Leur détection peut refléter une infection récente/active ou une interférence avec les IgM vaccinales (jusqu’à 2 mois après la vaccination). Le MAT permet aussi, moins spécifiquement, de détecter les IgM en même temps que les IgG.
Les IgG (ELISA ou MAT) ne sont pas détectables avant 3-4 semaines post-infection et peuvent refléter une infection chronique (datant de plusieurs mois voire plus d’un an) ou une interférence avec les IgG vaccinales (jusqu’à 4-6 mois après la vaccination).
Interprétation selon le statut vaccinal d’un chien suspecté de leptospirose :
– Animaux vaccinés depuis moins de 2 mois : une interférence vaccinale est possible quel que soit le test sérologique utilisé et un résultat positif pour les IgM ou les IgG (ELISA) ne permet pas de confirmer avec certitude une leptospirose. Une PCR (urines et sang) couplée au MAT est recommandée.
– Animaux vaccinés depuis plus de 2 mois mais moins de 6 mois : un résultat positif pour les IgM confirme une leptospirose. Un résultat positif pour les IgG peut refléter une interférence vaccinale jusqu’à 6 mois. En cas de résultat négatif pour les IgM et les IgG (ELISA), une PCR (urines et sang) couplée au MAT est recommandée.
– Animaux vaccinés depuis plus de 6 mois ou non vaccinés : un résultat positif pour les IgM confirme une leptospirose. Un résultat positif pour les IgG (ELISA) est également en faveur d’une leptospirose (chronique). En cas de résultat négatif pour les IgM et les IgG (ELISA), une PCR (urines et sang) couplée au MAT est recommandée.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
L’espèce pathogène Leptospira interrogans est divisée en plus de 260 sérovars, eux-mêmes regroupés en plus de 25 sérogroupes.
Le test d’Agglutination Microscopique (M.A.T.), réalisé avec des souches vivantes, permet une appréciation qualitative et quantitative de la réponse sérologique (détection des IgG et des IgM).
La plus haute dilution de sérum montrant encore une réaction d’agglutination avec 50% des leptospires correspond au titre rapporté dans les résultats.
Les souches employées représentent les sérogroupes estimés dominants épidémiologiquement en France.
Il est recommandé d’attendre 2-4 semaines après l’infection pour réaliser le test sérologique (risque de faux négatifs si le test est trop précoce). Un titre élevé (ex. > 1/800) est compatible avec une infection naturelle, et la spécificité augmente (70-100%) avec un titre très élevé (> 1/1600).
La mise en évidence d’une séroconversion lors d’un suivi sérologique (ex. titre multiplié par 4 deux semaines plus tard) est aussi très suggestive d’une infection récente.
On considère habituellement que le sérovar infectant correspond à celui ayant le titre le plus élevé.
Les titres sérologiques après une vaccination récente sont généralement plus faibles (néanmoins difficiles à distinguer d’une exposition/infection chronique) et tendent à se négativer après 4-6 mois (après 1 an pour une infection naturelle).
Liste des sérogroupes et sérovars testés :
AUSTRALIS : Australis (AUS), Bratislava (BRAT), Munchen (MUN); AUTUMNALIS : Autumnalis (Akiyami A) (AKI), Bim (BIM); BALLUM : Castellonis (BAL); BATAVIAE : Bataviae (BAT); CANICOLA : Canicola (CAN); GRIPPOTYPHOSA : Grippotyphosa (GRIP), Vanderhoedoni (VAN); ICTEROAEMORRHAGIAE : Copenhageni (COP), Icterohaemorrhagiae (IH); PANAMA : Mangus (MAN), Panama (PAN); POMONA : Mozdock (MOZ), Pomona (POM); PYROGENES : Pyrogenes (PYR); SEJROE : Hardjo (HJ), Saxkoebing (SAX), Sejroe (SJ), Wolffi (WOLF); TARASSOVI : Tarassovi (TAR).
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Des faux-négatifs sont possibles chez les très jeunes animaux ou en tout début d’infection, les résultats positifs ne traduisant que la réaction (éventuellement ancienne) de l’organisme au pathogène.
En phase aiguë de l’infection (parasitémie souvent synchrone de l’hyperthermie), un examen de frottis sanguin et une PCR peuvent être réalisés.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
L’augmentation des IgG survient généralement à partir de la deuxième semaine post-infection, mais prend parfois jusqu’à 6 semaines. Après le début de la production des IgG, le pic est atteint en 2 ou 3 semaines, ce qui laisse une petite fenêtre pour documenter une séroconversion significative entre deux analyses (infection active).
Les titres élevés peuvent persister pendant plusieurs années, ce résultat indique juste la présence de T. gondii dans l’organisme, mais pas nécessairement une infection active.
La présence d’anticorps ne signe pas la maladie mais le contact de l’animal avec le parasite.
La PCR peut aussi être réalisée au sein d’un prélèvement choisi en fonction de la forme clinique suspectée (humeur aqueuse, LCR, lavage broncho-alvéolaire, cytoponctions, biopsies pulmonaires/hépatiques, etc.).
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
L’augmentation des IgG survient généralement à partir de la deuxième semaine post-infection, mais prend parfois jusqu’à 6 semaines. Après le début de la production des IgG, le pic est atteint en 2 ou 3 semaines, ce qui laisse une petite fenêtre pour documenter une séroconversion significative entre deux analyses (infection active).
Les titres élevés peuvent persister pendant plusieurs années, ce résultat indique juste la présence de T. gondii dans l’organisme, mais pas nécessairement une infection active.
La présence d’anticorps ne signe pas la maladie mais le contact de l’animal avec le parasite.
La PCR peut aussi être réalisée au sein d’un prélèvement choisi en fonction de la forme clinique suspectée (humeur aqueuse, LCR, lavage broncho-alvéolaire, cytoponctions, biopsies pulmonaires/hépatiques, etc.).
La coproscopie est peu utile (aléatoire et souvent négative mais la sensibilité est nettement améliorée par une recherche PCR dans les selles).
Cas particulier du chat :
Des enquêtes de séroprévalence indiquent qu’une forte proportion de chats sont positifs et qu’elle augmente avec l’âge et le mode de vie (accès à l’extérieur).
Quel que soit le résultat sérologique, il est nécessaire de considérer le chat comme potentiellement dangereux pour la femme enceinte (même s’il ne représente pas, au moins en France, la source majeure de contamination). Une sérologie négative indiquera probablement une absence d’immunité protectrice du chat (avec risque d’infection et d’excrétion d’ookystes). Une sérologie positive indique le plus souvent une immunité efficace chez le chat. Toutefois, cette immunité peut aussi être faillible (surtout si infection récente avec excrétion d’ookystes, jeune chat primo-infecté, comorbidités, immunodéficience, etc.).
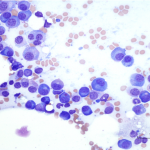
Cytologie : prélèvement et interprétation
1. Prélèvement (par ponction avec et sans aspiration, impression, grattage et écouvillon) :
Une bonne contention de l’animal est nécessaire.
Dans certains cas, une sédation devrait être utilisée si le site de prélèvement est situé près de structures délicates (ex. ponction hépatique), ou si l’animal est agité voire agressif. Une anesthésie générale peut être recommandée lorsqu’une immobilité complète est nécessaire (ex. : ponction de moelle osseuse). Pour une ponction cutanée, le site doit être propre et un léger nettoyage avec un tampon d’alcool est généralement suffisant. Une préparation chirurgicale du site de ponction devrait être effectuée si une culture bactériologique est envisagée ou si une cavité corporelle est pénétrée (ex. thorax, abdomen, articulation). La ponction à l’aiguille fine sans aspiration est la technique de choix pour la majorité des masses cutanées ainsi que pour de nombreux autres sites et tissus. Elle s’effectue par simple ponction de la lésion en utilisant une technique sans aspiration (avec aiguille démontée) ou une technique avec aspiration en employant une seringue attachée à l’aiguille. Les calibres d’aiguille recommandés sont de 21-G à 23- G, le calibre 22-G étant adéquat dans la majorité des cas (photo 1).

Le prélèvement s’effectue par l’exécution de nombreux mouvements de « va-et-vient » afin d’introduire des cellules et des fragments tissulaires dans l’aiguille. Il est recommandé de changer l’orientation de l’aiguille plusieurs fois au cours du prélèvement (photos 2). Pour des lésions dont le diamètre excède 1,5 cm, plusieurs parties de la lésion devraient être ponctionnées afin d’obtenir un échantillon plus représentatif. Enfin, lors du prélèvement « va-et-vient », il faut veiller à ne pas faire sortir l’aiguille de la lésion afin d’éviter que l’échantillon ne soit contaminé par des cellules cutanées ou adipeuses.

Un prélèvement par aspiration peut être utilisé si la ponction avec aiguille démontée ne permet pas d’obtenir un échantillon suffisamment cellulaire. La lésion est d’abord ponctionnée avec une aiguille fixée à une seringue dont le piston est préalablement rempli d’air (2 à 5 ml). La présence d’air dans la seringue permet d’éjecter rapidement l’échantillon contenu dans l’aiguille, de façon à éviter que la formation d’un caillot ne séquestre les cellules à examiner. Une fois le tissu pénétré, une pression négative est exercée à plusieurs reprises en retirant le piston jusqu’au 3/4 du volume de la seringue pour favoriser le détachement cellulaire/tissulaire. Une pression négative excessive doit être évitée pour ne pas rompre les vaisseaux environnants et ainsi causer une contamination sanguine périphérique. Comme pour la méthode sans aspiration, il est recommandé de changer l’orientation de l’aiguille dans le but d’obtenir un échantillon représentatif de la lésion.
Les impressions et les grattages peuvent être utilisés pour échantillonner des lésions cutanées superficielles, ou des lésions profondes obtenues en chirurgie ou en nécropsie.
Les impressions de lésions cutanées s’effectuent simplement en y apposant une lame et en exerçant une légère pression de telle sorte que les cellules adhèrent par capillarité. Pour un prélèvement à partir d’une biopsie, une nouvelle coupe dans le tissu est préparée et l’excès de fluides tissulaires et de sang est épongé à l’aide de papier absorbant. On prélève ensuite une petite section du tissu que l’on applique à plusieurs reprises sur la surface d’une lame de verre que l’on fait ensuite sécher à l’air libre.
Les grattages cutanés peuvent se réaliser au moyen d’une lame de bistouri émoussée en effectuant des mouvements de façon unidirectionnelle et perpendiculairement à la surface de la lésion. Le matériel récolté est ensuite déposé sur une lame de verre puis étalé. Idéalement, le grattage doit être suffisamment profond pour provoquer une exsudation de fluides tissulaires ou un léger saignement à la surface de la peau. L’impression est une méthode de prélèvement appropriée pour la recherche et l’identification de micro-organismes (bactéries, spores et hyphes fongiques). Le grattage est une technique particulièrement indiquée pour les lésions sèches et sans relief ou au niveau de certaines surfaces (ex. cornée ou conjonctive après anesthésie locale). Lors d’impression et de grattage, les couches cellulaires superficielles sont souvent les seules à être échantillonnées. De ce fait, les cellules plus profondes peuvent ne pas être représentées avec ces techniques, ce qui peut mener à un diagnostic erroné ou incomplet.
L’écouvillon est essentiellement utilisé pour les lésions fistuleuses, le canal auriculaire, les passages nasaux, les lésions de la cavité orale et le tractus génital externe (détermination du stade du cycle reproducteur). Il est légèrement humecté avec de la saline stérile, puis roulé ou frotté contre la surface à échantillonner. Le matériel est déposé sur une lame (par roulement) pour l’examen cytologique. Cette technique est peu utile pour le diagnostic de conditions néoplasiques.
2. Etalement de l’échantillon sur lame, séchage et coloration :
L’étalement de l’échantillon sur la lame doit se faire rapidement pour éviter que l’échantillon ne coagule ou ne se dessèche.
Il devrait fournir une couche monocellulaire constituée de cellules intactes pour permettre un examen cytologique optimale. Après le prélèvement, le contenu de l’aiguille est éjecté sur une lame de verre propre sur laquelle une deuxième lame est déposée délicatement et perpendiculairement à la première (photos 1 et 2 ci-dessous). L’échantillon est étalé en faisant glisser les deux lames l’une par rapport à l’autre. Idéalement, l’éjection du matériel doit se faire doucement et à proximité de la lame pour éviter une dispersion en « éclat d’obus » difficile à étaler (photo 3 ci-dessous). Il est important de ne pas appliquer une pression trop forte afin d’éviter une éventuelle rupture cellulaire. Certaines cellules, comme les lymphocytes néoplasiques, sont particulièrement fragiles et peuvent facilement se rompre au moment de l’étalement. La présence de nombreux noyaux libres sans cytoplasme, avec une grande quantité de filaments nucléaires, s’observent fréquemment si l’étalement a été effectué avec trop de pression (photos 4 et 5 ci-dessous). La présence d’une proportion importante de cellules éclatées est une cause fréquente d’échantillons non diagnostiques.
Le séchage de la lame contenant le matériel étalé doit se faire rapidement, en agitant la lame au contact de l’air.
Plusieurs lames devraient être préparées pour chaque lésion prélevée. Une ou deux lames d’une série peuvent être colorées et examinées au microscope par le praticien pour évaluer la cellularité de l’échantillon, la qualité de l’étalement et pour obtenir un diagnostic préliminaire. Les colorants de type rapide comme le Diff-Quick ou le RAL sont généralement utilisés pour la coloration cytologique de routine. Les lames colorées et non colorées sont ensuite envoyées au laboratoire dans une protection rigide (sans déposer de lamelle sur les lames à examiner).

Conditions de prélèvement :
Les liquides doivent être placés dans un tube EDTA (sauf LCS tube sec), expédiés au laboratoire sous 2-3 jours (sauf LCS voir ci-dessous), et maintenus au frais jusqu’à l’envoi. Si une bactériologie/mycologie est demandée conjointement, un tube sec devra être joint. Les PCR éventuelles seront réalisées sur le tube EDTA.
Une quantité suffisante de liquide (minimum 1-2 ml) est nécessaire pour la préparation de lames par cytocentrifugation, et pour la détermination du comptage cellulaire et du taux protéique au laboratoire.
Afin de préserver la morphologie des cellules contenues dans le liquide, deux manipulations très utiles peuvent être réalisées à la clinique :
1. Envoi au laboratoire de lames réalisées rapidement après avoir récolté le liquide.
Si le liquide apparaît opaque et de cellularité élevée (ex. péritonite, arthrite), un frottis direct peut être effectué.
Si le liquide semble peu cellulaire (ex. lavage), une partie de celui-ci peut être centrifugée (dans un tube à fond conique si possible) : les cellules concentrées au niveau du culot sont ensuite prélevées avec une pipette en plastique (en retirant le surnageant et en laissant 0.25 – 0.5 ml dans le fond du tube), puis déposées sur une lame et étalées comme un frottis.
2. Pour les liquides cérébrospinaux, il est recommandé d’ajouter du sérum du même animal (autologue) directement dans le liquide récolté (environ 10% du volume de l’échantillon récolté soit généralement 2-3 gouttes de sérum). Ce liquide pourra ensuite être envoyé au laboratoire pour réaliser l’examen cytologique. Un second tube contenant le LCS non modifié (sans ajout de serum) sera nécessaire pour la détermination du taux protéique.


* Procédures réalisées seulement si du liquide est reçu au laboratoire dans des conditions adéquates
Histopathologie : prélèvement et interprétation
La valeur du diagnostic sur pièce d’exérèse est déterminée par différents facteurs, notamment une taille adaptée, une localisation judicieuse du site de prélèvement et une fixation de bonne qualité.
Pour les prélèvements dont la taille est inférieure à 2 cm de diamètre, la pièce d’exérèse est envoyée dans son intégralité.
Une pièce plus volumineuse doit être préalablement sectionnée. En effet, le formol ne pénètre le tissu que dans une faible épaisseur (environ 1 cm pour du tissu compact).
Le prélèvement envoyé doit systématiquement inclure la zone de transition entre le tissu sain et le tissu lésionnel, quelle que soit la suspicion clinique ou la localisation de la lésion. En effet, l’examen de cette région de transition est capital car c’est là où siègent les lésions les plus récentes (et les plus spécifiques) du processus pathologique en cours. Dans le cas d’une lésion de nature tumorale, cette zone périphérique fournit de nombreuses informations, notamment sur la malignité de la tumeur (caractère infiltrant, emboles, etc.). De même, en cas de suspicion de malignité, et lorsqu’il peut être prélevé, le nœud lymphatique de drainage est joint afin d’établir le bilan d’extension histologique ganglionnaire.
Les pièces d’exérèse doivent être placées dans un flacon contenant du formol (solution commerciale tamponnée de formaldéhyde à 10 %). Il est fondamental de respecter un rapport d’au moins 10 entre le volume de formol et celui de la pièce à fixer. Dans un prélèvement mal fixé, le processus d’autolyse se poursuit, ce qui rend difficile son traitement technique et altère la qualité du diagnostic (dégradation de la morphologie cellulaire, développement bactérien).
Informations extraites de l’article « Comment optimiser un prélèvement histologique ou cytologique » Le Point Vétérinaire n° 316 du 01/06/2011
- Nombre de biopsies
Quelles que soient la lésion et sa localisation (cutanée, hépatique, rénale, intestinale), la multiplication des zones de biopsie permet d’augmenter les chances que le prélèvement examiné soit représentatif du processus pathologique en cours et de la totalité des structures histologiques de l’organe.
- Taille des biopsies
Les biopsies doivent être de la plus grande taille possible et inclure des zones représentatives. En effet, souvent, elles sont trop superficielles et ne ciblent pas les lésions d’intérêt permettant d’établir le diagnostic. C’est pourquoi, dans la mesure du possible (localisation de la lésion, état général de l’animal, hypothèses cliniques, temps, matériel), la biopsie doit comprendre les structures histologiques essentielles de l’organe. La peau, le rein et le foie se prêtent aux prélèvements de plus grande taille (1 à 2 cm de diamètre), à condition d’avoir exclu une coagulopathie et de suturer le lieu de la biopsie.
- Profondeur et localisation des biopsies
Lorsque la lésion à biopser mesure plus de 1 cm de diamètre, il est possible que le centre, nécrosé ou fibrosé, ne présente que peu d’intérêt diagnostique. Des prélèvements doivent donc être effectués, si possible, en périphérie, notamment dans la zone de transition entre le tissu lésionnel et le tissu sain. Cette région renseigne sur le caractère infiltrant ou non du processus, et sur la présence éventuelle d’emboles vasculaires pour les processus néoplasiques. Lors de biopsie cutanée, il convient de prélever également une zone saine (à moins que la lésion d’intérêt ne soit diffuse), afin de bénéficier d’un contrôle interne et de permettre au pathologiste de distinguer l’aspect physiologique de l’aspect pathologique.
- Quand pratiquer une biopsie ?
Il est souhaitable de réaliser les biopsies le plus précocement possible et sur les lésions les plus récentes. Ces dernières, souvent les plus représentatives, sont localisées en périphérie, à la frontière avec le tissu sain. Les lésions chroniques sont souvent peu spécifiques : les phases précoces du processus pathologique, souvent spécifiques et riches en informations, ont parfois disparu, laissant place à des remaniements tissulaires importants non représentatifs.
La biopsie est souvent proposée comme un examen de deuxième intention, parfois après la mise en place d’une thérapeutique susceptible de modifier l’aspect lésionnel de certains organes. L’arrêt de tout traitement 15 jours avant l’opération est conseillé.
- Limites des biopsies
Le prélèvement par biopsie est certes rapide et peu invasif, mais, pour certains organes, des prélèvements de plus grande taille, voire, parfois, une exérèse de l’organe entier sont préférables. Par exemple, les biopsies hépatiques larges permettent au pathologiste de mieux apprécier l’architecture du foie et d’affiner considérablement le diagnostic. Les biopsies ganglionnaires sont souvent peu lisibles et parfois non conclusives. De plus, certaines lésions ne se prêtent pas à un prélèvement par biopsie. C’est le cas souvent des tumeurs mammaires, surtout chez le chien (en raison de leur fréquente hétérogénéité) et des tumeurs péri-anales hépatoïdes. Le caractère infiltrant de la lésion visible sur la pièce d’exérèse complète constitue un critère décisif de malignité de la tumeur.
Informations extraites de l’article « Comment optimiser un prélèvement histologique ou cytologique » Le Point Vétérinaire n° 316 du 01/06/2011