Lexique des analyses
Biologie : prélèvement et interprétation
Immuno-hématologie
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours réfrigéré ou à T° ambiante
Interprétation :
– Si test positif : Un titrage en anticorps anti-nucléaires élevé permet de diagnostiquer un Lupus Erythémateux Systémique (LES) si le profil clinique (ex. fièvre, polyarthrite non-erosive, adénomégalie, splénomégalie, atteinte rénale, atteinte cutanée/muqueuse) et biologique (ex. AHMI, thrombopénie ou leucopénie) est très suspect. La spécificité et la valeur prédictive positive sont néanmoins faibles : un résultat positif peut accompagner une multitude d’autres maladies qu’un LES, ex. maladies inflammatoires infectieuses (ex. FIV et FeLV, Ehrlichia et Leishmania), néoplasmes, certains médicaments. Certains animaux apparemment sains peuvent même présenter des AcAn. Un résultat positif devra donc toujours être confronté à la présentation clinique.
– Si test négatif : Un résultat négatif en anticorps anti-nucléaires écarte un Lupus Erythémateux Systémique avec une forte probabilité (haute sensibilité).
Conditions de prélèvement :
Sang total EDTA
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
CHIEN
– Si test positif : Le test de Coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes. Si les éléments cliniques et biologiques concordent, un résultat positif est considéré comme très en faveur d’une AHMI : processus à médiation immunitaire primaire (autoimmun) ou secondaire (antigènes exogènes à rechercher – ex. infection vectorielle, leptospirose, médicament, etc.).
– Si test négatif : Le test de Coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes, avec toutefois 30-50% de faux négatifs (ex. faible titrage en anticorps, corticothérapie récente, délai d’analyse prolongé).
CHAT
– Si test positif : Le test de Coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes. Si les éléments cliniques et biologiques concordent, un résultat positif est considéré comme très en faveur d’une AHMI : processus à médiation immunitaire primaire (autoimmun) ou secondaire (antigènes exogènes à rechercher – ex. mycoplasmose, rétrovirose, médicament, etc.).
– Si test négatif : Le test de Coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes, avec toutefois 30-50% de faux négatifs (ex. faible titrage en anticorps, corticothérapie récente, délai d’analyse prolongé).
CHEVAL
– Si test positif : Le test de Coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes. Si les éléments cliniques et biologiques concordent, un résultat positif est considéré comme très en faveur d’une AHMI : processus à médiation immunitaire primaire (autoimmun) ou secondaire (ex. lymphome, AIE, Streptococcus sp., Clostridium sp., Pénicilline, Céphalosporine, Triméthoprime-Sulfamidés).
– Si test négatif : Le test de Coombs direct permet de mettre en évidence des anticorps dirigés contre les érythrocytes, avec toutefois 30-50% de faux négatifs (ex. faible titrage en anticorps, corticothérapie récente, délai d’analyse prolongé).
Conditions de prélèvement :
Envoi de 1-2 lames (si possible non colorées) avec un tube de sang total EDTA.
Conservation et stabilité du frottis sanguin (si envoi différé) : indéterminée (T°ambiante, non exposé aux vapeurs de formol)
Après prélèvement, le sang doit être rapidement transféré dans un tube EDTA. Le frottis doit être réalisé dans les plus brefs délais, à partir d’un échantillon sanguin frais et bien homogénéisé, pour prévenir toute dégradation morphologique des cellules. La préparation du frottis commence par le dépôt d’une goutte de sang (au moyen d’un tube capillaire) à l’extrémité de la lame. Cette goutte est ensuite étalée au moyen d’une seconde lame qui est glissée sur la première (photos 1a et 1b). Bien préparé, le frottis sanguin prend l’apparence d’une “langue de chat”. Cela indique que l’échantillon a été étalé correctement et permet l’observation d’un frottis sanguin de qualité.
La coloration se réalise de façon standard (Diff-Quick®, RAL®, Wright-Giemsa). Le frottis préparé doit être sec (séchage rapide à l’air par agitation des lames) avant coloration.
Pour mettre spécifiquement en évidence les réticulocytes, une coloration au nouveau bleu de méthylène peut être réalisée. Dans un tube en plastique, une goutte de sang est mélangée à une ou deux gouttes de nouveau bleu de méthylène. Le tube est laissé à température ambiante pendant 5-10 minutes. Une petite goutte du mélange est ensuite déposée sur une lame et étalée de la même façon que pour la réalisation du frottis sanguin. La lame est séchée rapidement à l’air et examinée au fort grossissement du microscope (× 50 à 100).

Interprétation :
En savoir plus sur :
– L’examen systématique du frottis sanguin
– L’évaluation des érythrocytes
– L’évaluation des plaquettes et des leucocytes
Conditions de prélèvement :
Sang veineux prélevé dans un tube EDTA.
Le tube EDTA est homogénéisé doucement et immédiatement après la ponction pour assurer le bon mélange anticoagulant-sang.
Le sang capillaire est utile pour la détection de certains parasites au frottis sanguin.
Un frottis sanguin est idéalement réalisé à la clinique et envoyé avec le tube EDTA (morphologie cellulaire préservée).
Conservation et stabilité du tube EDTA (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Anémie
Son interprétation repose sur l’évaluation de sa sévérité, la connaissance du comptage des réticulocytes (chien et chat) et une évaluation du frottis sanguin.
Le comptage des réticulocytes permet de déterminer le caractère régénérateur ou non de l’anémie au moment de la prise de sang chez le chien et le chat. Cette information est essentielle car elle permet de mieux trouver la cause de l’anémie. Les réticulocytes peuvent aussi être comptés au microscope avec une coloration spéciale (bleu de méthylène).
Une anémie est dite régénérative si les réticulocytes dépassent un certains seuil. La régénération témoigne de l’activité de la moelle osseuse. Une anémie régénérative s’explique par deux processus principaux :
1. Des pertes sanguines (saignements qui peuvent être internes ou externes)
2. Une hémolyse, ex. anémie hémolytique à médiation immunitaire, dommages oxydatifs, infection comm une piroplasmose ou une hémobartonellose.
Lors d’anémie non-régénérative la moelle osseuse ne produit pas ou pas suffisamment d’hématies. Il peut s’agir d’une anémie inflammatoire ou d’une anémie de maladie rénale chronique. L’absence de régénération peut aussi être lié à une atteinte structurelle et fonctionnelle de la moelle osseuse (ex : leucémie par remplacement du tissu normal). Enfin, une anémie hémorragique ou hémolytique sera d’abord non régénérative durant les 3-4 premiers jours suivants le début de l’affection.
Erythrocytose
On parle d’érythrocytose lorsque la masse érythrocytaire circulante est augmentée. On la détecte lorsque l’un des paramètres érythroides (Htc, Hg ou hématies) au moins est augmenté. Le plus souvent, ce changement est peu significatif et dit »relatif ». Dans ce cas, une hémoconcentration (déshydratation) ou une contraction splénique (stress) sont les principales causes. Un suivi est alors envisageable pour exclure une erythrocytose « absolue ».
Les érythrocytose absolues peuvent être primaires ou secondaires.
L’érythrocytose absolue secondaire peut elle-même être »appropriée » ou inappropriée ».
– L’érythrocytose absolue secondaire appropriée fait suite à une augmentation de la valeur de l’EPO qui est causée par une hypoxie systémique : maladies cardio-vasculaires. Ce groupe est également assez fréquent.
– L’érythrocytose absolue secondaire inappropriée est causée par une production (augmentation) de la valeur de l’EPO dans le sang, sans hypoxie. La production autonome d’EPO peut être d’origine rénale (kyste ou tumeur rénale) ou provenir d’une tumeur d’autre organe : hépatome, hepatoblastome, schannome, leiomyosarcome. Ces causes sont plutôt rares.
L’érythrocytose absolue primaire est (très) rare : la production d’hématies dans la moelle osseuse est autonome et anormale; la valeur de l’EPO est physiologique : c’est la polycytémie vera (leucémie érythroïde chronique).
Leucocytose
Son interprétation passe par l’évaluation de la sévérité de la leucocytose, de la formule (différentiel leucocytaire c’est-à-dire prédominance ou non d’un type de leucocyte) et enfin de la morphologie des cellules, évaluées au frottis sanguin.
– Leucogramme de stress :
Celui-ci se caractérise par une leucocytose neutrophilique qui peut être jusqu’à modérée. Une monocytose légère/modérée et une lymphopénie légère peuvent aussi être présentes.
– Leucogramme inflammatoire :
Une neutrophilie légère, modérée voire marquée est possible. Une neutropénie est également possible (plus rare). La lecture du frottis est intéressant pour rechercher des changements toxiques et une déviation de la courbe d’Arneth à gauche. Une monocytose légère à modérée est possible. Une lymphocytose réactionnelle est parfois possible.
– Leucocytose lors de néoplasme / hémopathie maligne : la lecture du frottis est indispensable. Il faut rechercher la présence de cellules atypiques circulantes et en apprécier les détails morphologiques.
La majorité des cas sont une leucémie ou un lymphome (stade V avec phase leucémique).
On différencie des leucémies « chroniques » et leucémies « aigues ». La démarche diagnostique des leucémies nécessite souvent l’évaluation de la moelle osseuse par un myelogramme.
– Autre :
Une lymphocytose légère avec une éosinophilie peut être présente dans les cas de maladie d’Addison (absence de formule de stress). La cortisolémie après stimulation à l’ACTH, la kaliémie, la natrémie et le ratio NA/K restent nécessaires à son diagnostic.
Une lymphocytose modérée (jusqu’à 17.103 /microL) peut être observée lors d’Ehrlichiose chronique. Les lymphocytes peuvent alors être à grains et une hypergammaglobulinémie peut être présente.
Leucopénie
La numération leucocytaire est abaissée dans son ensemble. Il faut tenir compte de la sévérité, du contexte clinique et de la formule pour bien l’interpréter. La neutropénie est le changement (le plus fréquent) qui affecte les granulocytes neutrophiles :
– Une neutropénie marginale peut être peu significative, en particulier si elle est constatée chez un animal âgé qui vit en intérieur et avec un bon état général.
– Une neutropénie légère à marquée peut aussi être secondaire à un foyer inflammatoire (rare chez le chien et le chat). Dans ce cas, la moelle ne produit pas assez de cellules en réponse à la demande (certains cas de péritonites, de pyomètres à col fermé, etc.). Ceci peut être transitoire ou au contraire le signe d’un épuisement de la moelle osseuse. Le frottis pourra révéler des signes de toxicité et une déviation de la courbe d’Arneth à gauche (une neutropénie de type dégénérative est très significative).
Une panleucopénie se caractérise par une diminution de la numération de tous les types leucocytaires : c’est un changement significatif. Les pathologies sous jacentes peuvent être variées et incluent des causes néoplasiques (ex. leucémie, lymphome), infectieuse (ex. parvovirose canine, panleucopénie féline, certains cas de FeLV) et toxiques.
La lymphopénie est souvent »isolée » et sans leucopénie. Parmi les causes les plus fréquentes, un effet du stress (corticostéroides endogènes) et une origine virale sont à prioriser.
Thrombopénie
Les grands processus pathologiques à l’origine d’une thrombopénie sont :
– Une consommation des plaquettes (ex. saignements notamment par anticoagulants, CIVD)
– Une destruction des plaquettes « à médiation immunitaire »
– Une anomalie de production des plaquettes (toxiques, agents infectieux, néoplasme)
Il est important d’exclure un artéfact par évaluation du frottis sanguin. La présence d’amas de plaquettes devrait notamment être recherchée. Il faut aussi s’assurer qu’il n’y a pas de caillot dans le tube EDTA.
Thrombocytose
Ce changement est souvent peu significatif. La thrombocytose est souvent dite »réactionnelle », accompagnant de nombreuses pathologies sous jacentes (inflammatoire, néoplasique, etc).
Conditions de prélèvement :
Sang total EDTA
Conservation et stabilité (si envoi différé) : <4 jours réfrigéré
Interprétation :
CHIEN
La plupart des accidents transfusionnels se produit lorsque du sang DEA 1.1 positif (antigène très immunogène à la surface des érythrocytes) est donné à un receveur DEA 1. 1 négatif. Un chien DEA 1.1 positif peut recevoir du sang DEA 1.1 positif ou négatif. Un chien DEA 1.1 négatif ne doit pas recevoir de sang DEA 1.1 positif. Les autres groupes sanguins (DEA 1.2, 3, 4, 5, 6, 7 et 8) ne causent pas de réaction transfusionnelle significative (les antigènes DEA 1.2 et 7 sont parfois plus immunogènes).
CHAT
Les accidents transfusionnels les plus graves se produisent entre un donneur du groupe A et un receveur du groupe B. La réaction est bien moins sévère entre un donneur du groupe B et un receveur du groupe A. Les receveurs de groupe AB ne présentent aucun risque transfusionnel.
Hémostase
Conditions de prélèvement :
Plasma citraté avec certaines précautions :
Prélèvement d’une veine de gros calibre (éviter une stase prolongée ou un garrot), utiliser un tube de citrate de sodium 3.8% (1 volume de citrate / 9 volumes de sang), mélanger doucement par retournements (vérifier l’absence de caillot). Centrifuger (15 min à 3000 G), récupérer le plasma dans un tube en plastique (vérifier l’absence d’hémolyse).
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Les D-Dimères résultent de la dégradation de la fibrine.
L’augmentation des D-dimères reflète un état hypercoagulable (thrombose voire CIVD) : ex. affections tumorales (hémangiosarcome, leucémie, sarcome histiocytaire,…), anémie hémolytique à médiation immunitaire, sepsis (et autres pathologies inflammatoires sévères), affections hépatiques, pancréatite, torsion d’organe, transfusion, hémorragie interne, etc.
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Une activité de moins de 30 % du facteur VIII est diagnostique de l’hémophilie A avec des conséquences cliniques probables. Au-delà de 30 %, l’affection est considérée comme mineure.
Ce type d’hémophilie est le plus répandu. Portée par le chromosome X et récessive, l’anomalie est majoritairement symptomatique chez le mâle (symptomatique chez la femelle quand les deux chromosomes X sont touchés). Les femelles porteuses ont une concentration de facteur VIII de 50 à 70 %.
Les tests de l’exploration de l’hémostase sont souvent normaux. Le temps de céphaline activée (TCA) est augmenté si la déficience en facteur VIII est majeure (> 75%).
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
Une activité de moins de 30 % du facteur VIII est diagnostique de l’hémophilie B avec des conséquences cliniques probables. Au-delà de 30 %, l’affection est considérée comme mineure.
Portée par le chromosome X et récessive, l’anomalie est majoritairement symptomatique chez le mâle (symptomatique chez la femelle quand les deux chromosomes X sont touchés). Les femelles porteuses ont une concentration de facteur VIII de 50 à 70 %.
Les tests de l’exploration de l’hémostase sont souvent normaux. Le temps de céphaline activée (TCA) est augmenté si la déficience en facteur IX est majeure (> 75%).
Les autres déficits congénitaux sont tous transmis de manière autosomale et sont peu fréquents. Ils sont souvent des découvertes fortuites lors d’une exploration de la coagulation plasmatique. Les saignements spontanés sont rares (déficit en facteur X) et surviennent souvent après des traumatismes (déficit en facteurs I et XI). Aucun déficit en facteurs V, XIII et HMWK n’a été décrit chez le Chien et le Chat.
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
En général, un résultat inférieur à 30% permet de confirmer la maladie de von Willebrand. Un chien présentant un résultat intermédiaire (50-65%) est le plus souvent asymptomatique mais considéré comme « porteur ».
Cette maladie héréditaire est décrite sous 3 formes :
Type 1 : le plus fréquent en particulier chez le Doberman Pinsher. Maladie de sévérité variable.
Type 2 : rare et surtout chez le Pointer. Forme clinique sévère.
Type 3 : plutôt chez le Scottish, le Retriever et le Berger des Shetland. Forme clinique sévère.
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
CHIEN
– Si fibrinogène > valeurs usuelles :
Une hyperfibrinogénémie est généralement secondaire à un processus inflammatoire (sub-)aigu (marqueur moins précis que la protéine C-réactive et à confronter aux autres marqueurs de l’inflammation – ex. leucogramme et frottis sanguin, globulines sanguines, électrophorèse des protéines sériques).
– Si fibrinogène < valeurs usuelles :
Le fibrinogène peut être diminué en cas de surconsommation (comme d’autres facteurs de la coagulation et les plaquettes) : ex. thrombose, CIVD, saignements abondants. Les déficiences congénitales sont très rarement décrites. Une coagulation in vitro (au moment de la prise de sang ou dans le tube – ex. délai) peut aussi faussement abaisser sa valeur.
CHAT
– Si fibrinogène > valeurs usuelles :
Une hyperfibrinogénémie est généralement secondaire à un processus inflammatoire (sub-)aigu (marqueur moins précis que la SAA et à confronter aux autres marqueurs de l’inflammation – ex. leucogramme et frottis sanguin, globulines sanguines, électrophorèse des protéines sériques).
– Si fibrinogène < valeurs usuelles :
Le fibrinogène peut être diminué en cas de surconsommation (comme d’autres facteurs de la coagulation et les plaquettes) : ex. thrombose, CIVD, saignements abondants. Les déficiences congénitales sont très rarement décrites. Une coagulation in vitro (au moment de la prise de sang ou dans le tube – ex. délai) peut aussi faussement abaisser sa valeur.
CHEVAL
– Si fibrinogène > valeurs usuelles :
Une hyperfibrinogénémie reflète un processus inflammatoire (sub-)aigu, avec contribution possible d’une déshydratation. D’autres marqueurs peuvent compléter le profil inflammatoire : SAA (plus précoce et plus sensible), leucogramme, frottis sanguin, globulines sanguines et électrophorèse des protéines sériques.
– Si fibrinogène < valeurs usuelles :
Le fibrinogène peut être diminué en cas de surconsommation (comme d’autres facteurs de la coagulation et les plaquettes) : ex. thrombose, CIVD, saignements abondants. Les déficiences congénitales sont très rarement décrites. Une coagulation in vitro (au moment de la prise de sang ou dans le tube – ex. délai) peut aussi faussement abaisser sa valeur.
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
– Si TCA > valeurs usuelles :
Les causes d’augmentation du temps de Céphaline Activée incluent une pathologie hépatique sévère, une CIVD et une intoxication aux rodenticides (le Temps de Quick augmente généralement en parallèle). Lors d’une augmentation isolée du TCA, il est recommandé de répéter le test (facteur VIII très labile). Si cette augmentation est réelle et persistante (> 30% des valeurs usuelles), un déficit congénital peut être envisagé (ex. hémophilie A – facteur VIII, maladie de Willebrand).
– Si TCA dans les valeurs usuelles :
Une coagulopathie précoce ou partielle ne peut être écartée lorsque le temps de Céphaline Activée est dans les valeurs usuelles, car il augmente après une perte d’activité > 70% d’un (ou plusieurs) facteur de coagulation.
Conditions de prélèvement :
Plasma citraté déposé dans un plastique
Conservation et stabilité : envoi sous 24h à T° ambiante sinon congélation à – 20°C (stable plusieurs semaines)
Interprétation :
– Si temps de Quick > valeurs usuelles :
Les causes d’augmentation du temps de Quick incluent une pathologie hépatique sévère, une CIVD et une intoxication aux rodenticides (le Temps Céphaline Activé augmente généralement en parallèle). Une augmentation isolée, significative (> 30% des valeurs usuelles) et persistante du TQ peut aussi être secondaire à une intoxication aux anticoagulants en phase suraigue (<7h) ou à un déficit en facteur VII (très rare).
– Si temps de Quick dans les valeurs usuelles :
Une coagulopathie précoce ou partielle ne peut être écartée lorsque le temps de Quick est dans les valeurs usuelles, car il augmente après une perte d’activité > 70% d’un (ou plusieurs) facteur de coagulation.
Biochimie
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
– Si CPSE > valeurs usuelles :
L’augmentation de la CPSE est spécifique d’une hyperplasie bénigne de la prostate. La CPSE est une hormone sécrétée par les cellules prostatiques, sous contrôle des androgènes. Cette protéine est normalement présente dans le sperme (représentant plus de 90% des protéines du liquide prostatique).
L’hyperplasie bénigne de la prostate peut prédisposer le chien à des affections plus graves (prostatites, kystes, abcès, etc.).
– Si CPSE dans les valeurs usuelles :
Une hyperplasie bénigne de la prostate peut être écartée avec une haute probabilité (< 3 % de faux négatifs) lorsque la CPSE est dans les valeurs usuelles.
Conditions de prélèvement :
Sérum exclusivement (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Hyperglobulinémie en alpha +/- béta (polyclonale) :
Cette hyperglobulinémie indique une inflammation « aigue » ou « active ». En effet, l’augmentation de la production des protéines de la phase aiguë (ex. SAA, haptoglobine, Protéine C réactive) peut causer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (infection, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
Hyperglobulinémie en béta (polyclonale) :
Cette hyperglobulinémie indique une inflammation « subaigue – chronique ». En particulier, l’augmentation de la production de certaines immunoglobulines (ex. IgA, IgM) et de certaines protéines du complément peut causer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (infection, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
Hyperglobulinémie en béta et gamma (polyclonale) :
Cette hyperglobulinémie indique une inflammation « subaigue – chronique ». En particulier, l’augmentation de la production de certaines immunoglobulines (ex. IgA, IgM et IgG) et de certaines protéines du complément peut causer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (infection, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
N.B : en cas d’atteinte hépatique chronique (surtout décrit dans l’espèce équine), il est possible d’observer un « pont béta-gamma » (limite indistincte entre ces 2 fractions protéiques).
Hyperglobulinémie en gamma (polyclonale) :
Cette hyperglobulinémie indique une inflammation « chronique » (> 1 semaine). En particulier, l’augmentation des immunoglobulines (IgG) et des protéines du complément peut engendrer ce type d’hyperglobulinémie.
L’origine de l’inflammation est variée (PIF, Ehrlichiose, Leishmaniose, processus dysimmunitaire, tumeur, etc.).
Une déshydratation peut aussi contribuer (surtout si hyperalbuminémie et/ou érythrocytose concomitantes).
Hyperglobulinémie monoclonale en gamma (gammopathie monoclonale) :
Cette hyperglobulinémie correspond probablement à la production d’un seul type d’immunoglobuline, par un « clone » de lymphocytes B ou de plasmocytes. Une tumeur lymphoïde peut être recherchée en priorité : lymphome, leucémie lymphoïde, myélome multiple, plasmocytome.
Dans de rares cas, une hyperglobulinémie « non-néoplasique » peut engendrer une gammopathie monoclonale : ex. Ehrlichiose canine, pyodermite chronique, Leishmaniose, certains processus dysimmunitaires.
Cas particuliers :
Péritonite infectieuse féline :
Les anomalies classiques en cas de PIF sont une augmentation des alpha et béta-globulines par l’hypersécrétion de protéines positives de l’inflammation aiguë (serum amyloïd A, haptoglobine et a1-glycoprotéine, notamment) et une augmentation polyclonale (exceptionnellement monoclonale) des gamma-globulines, due à une stimulation lymphoplasmocytaire accrue. Ces modifications ne sont pas pathognomoniques (faible valeur prédictive positive), mais le diagnostic de PIF est très peu probable en cas d’absence de modification du protéinogramme (valeur prédictive négative proche de 100 %).
Aussi, un rapport albumine/globulines augmenté (> 0,6) est très peu en faveur d’un diagnostic de PIF, alors qu’un rapport diminué (< 0,6) oriente vers un diagnostic de PIF sans permettre pour autant d’établir le diagnostic (d’autres maladies sont possibles telles qu’un lymphome, un myélome multiple, une infection par le FIV, un processus inflammatoire chronique, etc.).
Leishmaniose :
La leishmaniose est à l’origine d’une réponse immunitaire particulière dont les caractéristiques sont directement liées à la progression de la maladie. Tant que l’immunité cellulaire prévaut sur l’immunité humorale, l’expression clinique est peu intense, voire inexistante. Lorsque la maladie progresse et s’aggrave, la stimulation lymphoplasmocytaire qui en résulte se traduit par une production accrue d’immuno-globulines. Sur le tracé électrophorétique, une progression des alpha 2-globulines et une augmentation en béta ou en gamma-globulines polyclonales, rarement oligoclonales et exceptionnellement monoclonales, sont observées. Une élévation des béta-globulines et une diminution de l’albuminémie sont également fréquemment notées. Ces modifications protéiques permettent la détermination du stade de la maladie chez le chien, nécessaire à l’adaptation thérapeutique.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 24h à T° ambiante et plusieurs jours si réfrigéré
Interprétation :
– Si fructosamine > valeurs usuelles :
Diagnostic : les fructosamines réflètent les variations de glycémie sur les 15 derniers jours. Une valeur élevée de fructosamines (avec des SC concordants et une glucosurie) est diagnostique d’un diabète sucré (un stress chronique, une hyperprotéinémie et une hypothyroïdie peuvent parfois faire augmenter les fructosamines).
Suivi de traitement : une valeur de fructosamines < 500 µmol/l correspond généralement à un chien diabétique « équilibré » (dose correcte). Au-delà, le diabète est considéré comme « mal équilibré ». L’objectif thérapeutique se situe idéalement entre 350 et 400 µmol/l.
– Si fructosamine < valeurs usuelles :
Une valeur basse de fructosamines est généralement non significative (dégradation, hypoprotéinémie) sauf en cas d’insulinome (paramètre toutefois peu sensible et à confronter au contexte clinique).
– Si fructosamine dans les valeurs usuelles :
Une valeur de fructosamines dans les valeurs usuelles écarte à priori un diabète sucré (faux positifs toutefois possibles : diabète précoce, dégradation, hypoprotéinémie).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 24h à T° ambiante et plusieurs jours si réfrigéré
Interprétation :
– Si fructosamine > valeurs usuelles :
Diagnostic : les fructosamines réflètent les variations de glycémie sur les 15 derniers jours. Une valeur élevée de fructosamines (avec des SC concordants et une glucosurie) est diagnostique d’un diabète sucré (un stress chronique et une hyperprotéinémie peuvent parfois faire augmenter les fructosamines).
Suivi de traitement : une valeur de fructosamines < 500 µmol/l correspond généralement à un chat diabétique « équilibré » (dose correcte). Au-delà, le diabète est considéré comme « mal équilibré ». L’objectif thérapeutique se situe idéalement entre 350 et 400 µmol/l.
– Si fructosamine < valeurs usuelles :
Une valeur basse de fructosamines est généralement non significative (dégradation, hypoprotéinémie, hyperthyroïdie).
– Si fructosamine dans les valeurs usuelles :
Une valeur de fructosamines dans les valeurs usuelles écarte à priori un diabète sucré (faux positifs toutefois possibles : diabète précoce, dégradation, hypoprotéinémie, hyperthyroïdie).
Conditions de prélèvement :
Sérum (tube sec), plasma (EDTA ou hépariné)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
IgG < 200 : Déficit très sévère de transfert d’immunité passive.
IgG entre 200 et 400 : Déficit sévère de transfert d’immunité passive.
IgG entre 400 et 800 : Déficit partiel de transfert d’immunité passive.
IgG > 800 : Transfert d’immunité passive satisfaisant.
Conditions de prélèvement :
Sérum (tube sec) rapidement séparé
Conservation et stabilité : envoi sous 24h si possible réfrigéré sinon congélation à – 20°C (stable plusieurs jours/semaines)
Interprétation :
Le NT-proBNP est un biomarqueur cardiaque fonctionnel. Son augmentation est synonyme d’insuffisance cardiaque (dysfonctions systolique et/ou diastolique, surcharge volémique) ou d’hypertension pulmonaire chez le chien et le chat.
Il peut être intéressant dans les situations suivantes chez le chien :
– Diagnostiquer une cardiopathie si > 900 pmol/l. De plus, la valeur du NT-proBNP augmente avec la sévérité de l’insuffisance cardiaque.
– Le dosage du NT-proBNP permet d’approximer le délai avant décompensation lors de maladie valvulaire mitrale non décompensée. Une valeur > 466 pmol/l permet de prédire une décompensation à 1 an chez ces animaux. Une valeur > 1500 pmol/l indique une décompensation.
– Le dosage du NT-proBNP permet d’établir un pronostic de survie lors d’insuffisance cardiaque, chez le chien présentant une maladie valvulaire mitrale.
Chez les animaux insuffisants cardiaques de stades 2 et 3 confondus, la durée de vie médiane est de 146 jours pour une valeur > 1 500 pmol/l. Pour une valeur < 1 500 pmol/l, la durée de vie médiane est supérieure à 6 mois.
Chez les animaux insuffisants cardiaques de stade 2, une valeur > 1 265 pmol/l établit une médiane de survie de 130 jours, une valeur < 1 265 pmol/l, une médiane supérieure à 6 mois.
Enfin, chez les animaux insuffisants cardiaques de stade 3, une valeur > 2 700 pmol/l correspond à une médiane de survie de 5 jours, une valeur < 2 700 pmol/l, à une médiane supérieure à 6 mois.
– Le dosage du NT-proBNP prédit aussi la durée de survie lors de maladie valvulaire mitrale chez le chien traité. Une valeur < 965 pmol/l indiquerait une espérance de vie de 500 jours chez 50 % des chiens, une valeur > 965 pmol/l après la mise en place d’un traitement, une espérance de vie de 200 jours chez 50 % des chiens.
– Le NT-proBNP aide au diagnostic d’une cardiomyopathie chez le doberman, quel que soit le stade (occulte ou non). Une valeur > 400 pmol/l peut permettre le diagnostic.
En phase occulte, avec ou sans autre examen, une valeur > 457 pmol/l peut permettre le diagnostic (avec une forte certitude si > 900 pmol/l).
Il peut être intéressant dans les situations suivantes chez le chat :
– Diagnostiquer une cardiopathie : une valeur < 90 pmol/l écarte totalement une cardiopathie, une valeur >150 pmol/l la confirme avec certitude. Entre ces 2 valeurs le résultat peut être douteux.
– Le NT-proBNP permet le diagnostic différentiel entre une maladie cardiaque et une maladie respiratoire chez le chat. Une valeur seuil de 265 pmol/l peut séparer les animaux présentant une dyspnée aiguë secondaire à une maladie cardiaque de ceux présentant une dyspnée aiguë secondaire à une pneumopathie pure.
– Le NT-proBNP est utile pour le diagnostic étiologique différentiel d’un épanchement pleural d’origine cardiaque ou d’une autre origine (infectieuse ou tumorale, par exemple). Une valeur supérieure > 258 pmol/l permet d’orienter l’épanchement pleural vers une origine cardiaque.
– Une valeur du NT-proBNP > 250 pmol/l indique un pronostic vital lors de cardiomyopathie hypertrophique d’une durée médiane de 764 jours, contre 1 257 jours si la valeur est < 250 pmol/l.
Certaines affections extracardiaques peuvent être associées à une élévation du NT-proBNP : hyperthyroïdie, azotémie, hypertension artérielle, syndrome inflammatoire sévère.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Tout syndrome inflammatoire (immun, infectieux, nécrose, traumatisme, etc.) entraîne une synthèse hépatique de protéine C-réactive. La production est très précoce et suit une variation exponentielle de sa concentration plasmatique dès 4-6 heures après l’initiation du stimulus inflammatoire, avec un pic atteint à 24-48 heures. Sa concentration chute rapidement dans les 24 heures suivant la résolution du processus inflammatoire.
La CRP a une valeur plasmatique usuelle comprise entre 0 et 1 mg/dl. Une valeur > 3 mg/dl suggère fortement une inflammation systémique. Les concentrations comprises entre ces 2 seuils sont équivoques (ex. inflammation précoce, discrète ou en cours de résolution).
Les 3 maladies inflammatoires où ce marqueur se révèle particulièrement utile (dépistage, suivi et pronostic) sont : les polyarthrites, les méningites dysimmunitaires, et les pneumonies infectieuses.
Son intérêt est également rapporté dans le dépistage/suivi/pronostic d’infections bactériennes variées (pyomètre, pyélonéphrite, pyodermite, prostatite, leptospirose, ehrlichiose), de pancréatite aiguë, de parvovirose, d’infections parasitaires (piroplasmose, leishmaniose, dirofilariose, angiostrongylose), de processus dysimmunitaires (AHMI, MICI) ou de processus néoplasiques (lymphome).
Conditions de prélèvement :
Collecte par cystocentèse, cathétérisme ou miction naturelle. Le RPCU mesuré sur des urines obtenues à la clinique est supérieure à la valeur mesurée sur celles récoltées au domicile de l’animal (stress). Cette surestimation est plus forte chez les chiens protéinuriques versus non protéinuriques. En revanche, le moment de collecte dans la journée importe peu.
Conservation et stabilité (si envoi différé) : stable pendant 15 jours à +4 °C et 3 jours à température ambiante.
Interprétation :
CHIEN ET CHAT
– Si RPCU > 2 :
Un RPCU > 2 de façon persistante (sans inflammation/hémorragie du tractus urinaire) est en faveur d’une atteinte glomérulaire (souvent très élevé lors d’amyloïdose ou de glomérulonéphrite). Dans les atteintes tubulaires, le RPCU est généralement entre 1 et 2.
– Si RPCU entre 0.5 et 2 chez le chien ou 0.4 et 2 chez le chat :
Un RPCU augmenté de façon persistante (sans inflammation/hémorragie du tractus urinaire) est en faveur d’une atteinte rénale (glomérulaire et/ou tubulaire).
– Si RPCU entre 0.2 et 0.5 chez le chien ou 0.2 et 0.4 chez le chat :
Cet intervalle de valeurs (sans inflammation/hémorragie du tractus urinaire) est compatible avec une atteinte rénale, notamment en présence de signes cliniques et biologiques suspects (azotémie, SDMA augmentée, DU faible, etc.). Une variation biologique et des facteurs extra-rénaux – ex. hypercorticisme – peuvent aussi causer une protéinurie transitoire; un suivi peut donc être réalisé.
– Si RPCU < 0,2 :
RPCU dans les valeurs usuelles.
CHEVAL
– Si RPCU > valeurs usuelles :
Le RPCU permet de quantifier/confirmer une protéinurie visible à la bandelette urinaire. Cette protéinurie peut être d’origine rénale (glomérulaire voire tubulaire) ou hémorragique/inflammatoire (ex. pyélonéphrite, cystite, lithiase, tumeur, etc.). Le RPCU est donc interprété en fonction de l’examen microscopique de l’urine : un RPCU élevé sans inflammation/hématurie significative sera en faveur d’une atteinte rénale.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La sérum amyloïde A (SAA) est une protéine d’origine hépatique dont le taux sanguin augmente dans les 6 à 12 heures lors d’inflammation systémique. Son pic, parfois très élevé (X 1000), est atteint en 48 heures, et redescend rapidement lorsque l’inflammation est maîtrisée. Le dosage de la SAA permet donc de repérer très précocement un phénomène inflammatoire et d’aider au suivi du traitement.
Les valeurs de référence peuvent varier : elles sont plus élevées chez les poulinières, de la semaine précédant la parturition jusqu’à 1 mois après. On observe également une élévation modérée de la SAA chez les chevaux de course et d’endurance après l’effort, avec un retour à la normale en quelques jours. La vaccination peut aussi faire augmenter la SAA pendant plusieurs jours.
– Chez le cheval adulte, la SAA permet notamment de distinguer les affections respiratoires bactériennes (forte élévation) des affections virales (élévation modérée et aléatoire) ou allergiques (élévation faible ou normale). La SAA permettrait également de distinguer les affections digestives inflammatoires (ex. entérite, péritonite) versus non inflammatoires (ex. obstructives).
– Chez le poulain, un seuil de 100 mg/l a été proposé pour distinguer une pathologie infectieuse versus non infectieuse. Cependant, certaines infections (ex. omphalophlébites ou Rhodococcose), probablement parce qu’elles restent localisées, ne s’accompagnent pas toujours d’une telle élévation.
– Chez la jument poulinière, la SAA permettrait de détecter précocement une placentite, une métrite aiguë ou un pyomètre.
– En cas d’affection articulaire, une élévation de la valeur de la SAA a été proposée pour faire la distinction entre affection non-septique et septique, avec une valeur seuil de 60 mg/l pour les affections septiques.
– La réponse postchirurgicale normale est une augmentation de la SAA, puis une diminution rapide. Une hausse anormalement prolongée peut indiquer la survenue de complications postopératoires. Lors de chirurgie mineure, sans complications, la valeur de la SAA augmente entre 100 et 400 mg/l, avec un pic 3 jours postchirurgie et un retour à la normale 7 jours après environ.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Dans toutes les études, chez le chat, l’augmentation de la concentration de SAA est plus précoce que celle des marqueurs traditionnels, tels que la numération leucocytaire ou la protidémie, et le retour aux valeurs initiales plus rapide après cessation de la réaction. L’intensité de l’augmentation est également le plus souvent plus forte que pour les autres marqueurs. Cette augmentation est en général de l’ordre de 5 à 10 fois la valeur de base, mais elle atteint parfois un facteur 100. Lorsque des marqueurs traditionnels comme la leucocytose ou la neutrophilie sont utilisés pour identifier un processus inflammatoire, entre 40 et 50 % des chats ne présentent aucune modification de ces variables lors d’un processus inflammatoire.
Les variations les plus fréquentes et les plus intenses sont observées lors d’infections ou d’inflammations, par exemple par le virus de l’immunodéficience féline (FIV) ou lors de péritonite infectieuse féline (PIF), mais aussi dans quelques rares cas de cancers ou d’hypoglycémie ou lors de chlamydiose. Une augmentation est également observée après des interventions chirurgicales, même simples, comme une castration ou une ovario-hystérectomie.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 4 jours à température ambiante et 14 jours à 4 °C
Interprétation :
Une augmentation de la SDMA indique une diminution du taux de filtration glomérulaire : atteinte rénale, pré-rénale (ex. déshydratation, choc), ou post-rénale.
La SDMA augmente en moyenne après 40% de perte de fonction rénale (versus 75% environ pour la créatinine), soit 9 et 14 mois avant la créatinine chez les chiens et les chats atteints de maladie rénale chronique, respectivement. Contrairement à la créatinine, sa valeur est peu ou pas affectée par des facteurs extra-rénaux (ex. masse musculaire).
Une atteinte rénale est typiquement confirmée lors de perte concomitante de la capacité à concentrer l’urine (densité urinaire < 1.030 chez le chien et < 1.035 chez le chat) et de RPCU augmenté (en l’absence d’inflammation/hématurie à l’urologie).
La valeur seuil de référence de la SDMA classiquement retenue pour détecter une atteinte du débit de filtration glomérulaire est de 14 µg/dl (sensibilité de 90 % pour la détection d’une baisse du DFG de plus de 40 %). Cependant, la spécificité est médiocre (environ 50 %). Une étude montre qu’une valeur seuil modifiée de 18 µg/dl autorise une sensibilité toujours importante (90 %) mais augmente la spécificité à 83 %.
Les publications rapportent une variation intra-individuelle de la SDMA dans le temps qui est plus importante que celle de la créatinine et ne relève pas nécessairement de l’évolution d’une pathologie rénale. Ainsi, il faudra une variation de SDMA de près de 6 μg/dl entre deux mesures pour considérer l’évolution comme significative.
L’une des applications les plus pertinentes de la SDMA dans le cadre d’une maladie concomitante non rénale est son usage pour le dépistage d’une néphropathie chronique chez le chat hyperthyroïdien sans azotémie. Une étude montre qu’une valeur de SDMA supérieure à 10 μg/dl lors du diagnostic d’hyperthyroïdie chez le chat a une sensibilité de 79 % et une spécificité de 85 % pour le dépistage d’une néphropathie contemporaine, ne se manifestant pas nécessairement par une augmentation de la créatinine avant la prise en charge de l’hyperthyroïdie.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une augmentation de la SDMA indique une diminution du taux de filtration glomérulaire : atteinte rénale, pré-rénale (ex. déshydratation, choc), ou post-rénale. Il s’agit d’un marqueur plus précoce (plus sensible) que la créatinine.
Chez le cheval également, la SDMA n’est pas influencée par le sexe, l’âge, ou la race. Son intérêt a notamment été démontré dans les atteintes rénales aigues.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La concentration des sels biliaires peut augmenter en raison d’une diminution de la masse fonctionnelle hépatique (ex. hépatite chronique, nécrose, néoplasme diffus), un shunt vasculaire (ex. SPS congénital ou acquis) ou une cholestase. La sévérité et la nature précise de l’atteinte hépatobiliaire ne peuvent être précisées par la seule mesure des sels biliaires.
Chez le chien/chat, il est recommandé de doser la concentration pré (à jeun) et post-prandiale (2h après un repas riche en graisses). La valeur basale est parfois supérieure à la valeur post-prandiale (contraction spontanée de la vésicule biliaire avant le repas).
Il s’agit d’un paramètre sensible pour mettre en évidence une dysfonction hépatobiliaire (sensibilité proche de 80%), en particulier un shunt porto-systémique (sensibilité proche de 100% dans ce cas). Ce paramètre est également très spécifique (proche de 100%).
Note : la fiabilité de ce paramètre est proche de l’ammonium, avec le net avantage d’être bien plus stable (l’ammonium doit être mesuré sur un plasma rapidement séparé, non hémolysé, non exposé à l’air, et maintenu à 4°C jusqu’à la mesure (<4 h)).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La concentration des sels biliaires peut augmenter en raison d’une diminution de la masse fonctionnelle hépatique, un shunt vasculaire ou une cholestase. La sévérité et la nature précise de l’atteinte hépatobiliaire ne peuvent être précisées par la seule mesure des sels biliaires : atteinte toxique (ex. alcaloïde pyrrolizidinique, mycotoxines), atteinte infectieuse (ex. parasites, cholangiohépatite ascendante, parvovirus), néoplasie, lipidose hépatique, etc. Une biopsie hépatique est souvent nécessaire pour préciser l’étiologie.
Contrairement à la bilirubine (hyperbilirubinémie non conjuguée), une anorexie prolongée (< 3 jours) n’affecte pas les sels biliaires chez le cheval. Une augmentation post-prandiale n’est pas non plus observée (absence de vésicule biliaire et donc de contraction post-prandiale) ; la mesure des sels biliaires peut être réalisée à n’importe quel moment de la journée.
Les sels biliaires sont plus élevés chez le poulain de moins de 6 semaines.
Note : la fiabilité de ce paramètre est équivalente à l’ammonium, avec le net avantage d’être bien plus stable (l’ammonium doit être mesuré sur un plasma rapidement séparé, non hémolysé, non exposé à l’air, et maintenu à 4°C jusqu’à la mesure (<4 h)).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec) rapidement séparé
Conservation et stabilité : envoi sous 24h si possible réfrigéré sinon congélation à – 20°C (stable plusieurs jours/semaines)
Interprétation :
La troponine I est un biomarqueur cardiaque lésionnel qui peut être augmenté dans les situations suivantes :
– Myocardite chez le chien (critère diagnostique majeur si la TnI est > 1000 ng/l)
– Maladie valvulaire mitrale dégénérative du chien
– Dyspnée d’origine cardiaque (TnI > 660 ng/l) versus respiratoire (TnI < 240 ng/l) chez le chat
– Cardiopathie congénitale du chien telle que la sténose aortique ou pulmonaire
– Cardiomyopathie dilatée du chien (probable si TnI > 210 ng/l, peu probable si TnI < 60 ng/l)
– Cardiomyopathie arythmogène du ventricule droit du Boxer (probable si TnI > 110 ng/l, peu probable si TnI < 90 ng/l)
– Cardiomyopathie hypertrophique du chat (probable si TnI > 163 ng/l, peu probable si TnI < 60 ng/l)
– Souffle cardiaque asymptomatique
– Épanchement péricardique chez le chien, notamment en cas de péricardite et d’hémangiosarcome
– Maladies parasitaires telles qu’une dirofilariose ou une leishmaniose viscérale (avec cardiopathie)
– Traumatisme thoracique chez le chien et le chat
– Cardiotoxicité à la doxorubicine (excellent marqueur = nettement plus sensible et précoce que l’échocardiographie)
La TnI présente une grande variabilité biologique. Lors de dépistage ou de suivi d’animaux cardiaques, une différence de plus de 100-130% entre 2 mesures est considérée comme significative.
De nombreuses affections extracardiaques peuvent être associées à une élévation des biomarqueurs cardiaques : hyperthyroïdie, Cushing, Addison, azotémie, hypertension artérielle, anémie sévère, inflammations sévères (ex. pancréatite), lymphome, épilepsie, affections respiratoires, causes physiologiques (chiens âgés ou chats > 5kg).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec) rapidement séparé
Conservation et stabilité : envoi sous 24h si possible réfrigéré sinon congélation à – 20°C (stable plusieurs jours/semaines)
Interprétation :
La troponine I est un biomarqueur cardiaque lésionnel qui peut être utile dans les lésions du myocarde, notamment lors de myocardite aiguë d’origine virale (ex. influenza, morbillivirus), bactérienne (ex. secondaire à une infection streptococcique chez l’adulte) ou toxique (intoxication par les ionophores).
Des augmentations des taux sériques de la troponine I cardiaque ont aussi été démontrées chez des chevaux sains après un effort physique intense et chez des poulains souffrant de septicémie.
Endocrinologie
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une diminution des folates indique la présence d’une malabsortion intestinale chronique (duodénum).
Une prolifération bactérienne intestinale peut au contraire faire augmenter les folates.
Conditions de prélèvement :
Plasma EDTA
Le prélèvement peut être fait à n’importe quel moment de la journée. Le stress (ex. transport, hospitalisation, douleur, maladie systémique, etc.) peut toutefois faire augmenter l’ACTH (généralement < 75 pg/mL).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Les valeurs de référence de l’ACTH varient en fonction de la saison (augmentation physiologique en fin d’été et à l’automne pour préparer l’animal à l’hiver) et l’interprétation des résultats doit absolument tenir compte du contexte clinique.
Différentes conditions peuvent faire augmenter la production d’ACTH : le stress, un transport (faire la prise de sang au minimum 30 min après le débarquement), le jeûne, un syndrome inflammatoire (comme la fourbure), une mauvaise condition physique, la douleur… Certains équidés présentent une augmentation plus importante de l’ACTH à l’automne : les chevaux gris, les poneys rustiques (Shetlands, Morgan, Welsch), les chevaux arabes, les pures races espagnoles, les ânes…
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
CHAT
– Aldostérone basale : une valeur > 550 pmol/l est compatible avec un hyperaldostéronisme primaire, en revanche une valeur < 200 pmol/l rend cette hypothèse très peu probable.
– Aldostérone post-ACTH : les valeurs « usuelles » se situent entre 350 et 850 pmol/l.
Faux négatifs et faux positifs fréquents : d’une part, la valeur d’aldostérone (surtout basale) des chats atteints d’hyperaldostéronisme peut être similaire à celle des chats sains. D’autre part, une valeur élevée peut être associée à un hyperaldostéronisme secondaire (fonctionnel) regroupant l’ensemble des maladies qui active le système rénine-angiotensine-aldostérone (notamment maladie cardiaque et maladie rénale chronique).
Dans les zones « grises », le contexte clinique et les examens complémentaires peuvent orienter vers un hyperaldostéronisme primaire : ex. visualisation d’une masse surrénalienne à l’imagerie, faiblesse généralisée progressive associée à une hypokaliémie souvent sévère (K+ < 3 mmol/l), hypertension.
CHIEN
– Aldostérone basale : cette mesure est surtout utile pour écarter un hypoaldostéronisme, en particulier si la valeur est > 30 pmol/l. Une valeur basse voire effondrée (< 12 pmol/l) ne permet pas de conclure à un hypoaldostéronisme.
– Aldostérone post-ACTH : une valeur effondrée (< 12 pmol/l) permet de conclure à un hypoaldostéronisme (probable si < 100 pmol/l), en revanche une valeur > 250 pmol rend cette hypothèse très peu probable.
Il est attendu que l’aldostérone soit diminuée lors d’hypoadrénocorticisme primaire et « normale » lors d’hypoadrénocorticisme atypique (déficience isolée en glucocorticoïdes) ou d’hypoadrénocorticisme secondaire (déficience en ACTH – rare). Dans l’exploration initiale de l’hypoadrénocorticisme primaire, il est toujours conseillé de mesurer le cortisol basal et post-ACTH car la mesure seule de l’aldostérone présente un risque de faux positifs et de faux négatifs (même chez des chiens ayant des troubles électrolytiques). De plus, les déficiences isolées en aldostérone (sans déficience en glucocorticoïdes) sont très rares.
L’hyperaldostéronisme primaire est très rarement décrit chez le chien. Une valeur élevée (ex. valeur basale > 500 pmol/l et post-ACTH > 850 pmol/l) peut être associée à un hyperaldostéronisme secondaire (fonctionnel) regroupant l’ensemble des maladies qui active le système rénine-angiotensine-aldostérone (notamment maladie cardiaque et maladie rénale chronique).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
– Chez la femelle adulte, le dosage simultané de la progestérone et de l’AMH permet de déterminer le statut gonadique avec une excellente valeur prédictive positive.
Cas particulier : l’AMH peut être (très) basse en phase diœstrale (en revanche la progestéronémie sera élevée et confirmera la présence d’un tissu ovarien).
– Chez le mâle adulte le dosage simultané de la testostérone et de l’AMH montre aussi une très bonne précision pour déterminer le statut gonadique.
Femelle entière : 0,2 – 5,0 ng/mL
Femelle stérilisée (+/- diœstrus) : < 0,15 ng/mL
Mâle entier : 0,2 – 73,4 ng/mL
Mâle castré : < 0,15 ng/mL
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
– Jument : suspicion forte de tumeur de la granulosa pour une concentration d’hormone anti-mullérienne supérieure à 10 ng/mL
– Mâle : < 2 ng/mL si castration complète et > 2 ng/mL si présence de tissu testiculaire. Valeur souvent plus élevée chez les cryptorchides.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
3 prélèvements : T0 (avant dexaméthasone), T1 (après 4h) et T2 (après 8h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
– Diagnostic du syndrome de Cushing par freination à la dexaméthasone faible dose (0.01 mg/kg en IV) :
1/ Hypercorticisme probable si freinage absent ou partiel (T4h et T8h > 27.6 nmol/l)
2/ Hypercorticisme très peu probable si freinage complet (T4h et T8h < 27.6 nmol/l)
3/ Les profils « d’échappement » (T4h < 27.6 nmol/l et T8h > 27.6 nmol/l) ou « inversés » (T4h > 27.6 nmol/l et T8h < 27.6 nmol/l) sont douteux et ne permettent pas de conclure. Il est recommandé de répéter le test après quelques semaines.
– Origine du Cushing hypophysaire vs surrénalienne par freination à la dexaméthasone faible dose (0.01 mg/kg en IV) :
Une freination partielle (cortisolémie à 4h et/ou à 8h < 50% de la valeur à T0) est compatible avec une origine hypophysaire. Cette déduction est possible chez 2/3 des chiens avec un hypercorticisme hypophysaire.
Une freination insuffisante ou absente à 4h et à 8h ne permet pas de conclure sur l’origine hypophysaire vs surrénalienne. Un test de freination à la dexaméthasone forte dose (0.1 mg/kg en IV) peut alors être tenté : 1/4 des chiens avec un hypercorticisme hypophysaire ne montreront pas non plus de freination suffisante avec ce test (à 4h et à 8h) et l’origine de la maladie ne pourra être précisée.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
2 prélèvements : T0 (avant ACTH), T1 (après 1h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Diagnostic du syndrome de Cushing avec stimulation à l’ACTH (5 µg/kg IV ou IM – mesure à T0 et T+1h) :
Une valeur de cortisolémie post-simulation > 580 nmol/l est en faveur d’un syndrome de Cushing. Un résultat entre 500 et 580 nmol/l peut être considéré comme équivoque.
Une valeur de cortisolémie post-simulation > 680 nmol/l permet de conclure à un syndrome de Cushing avec une probabilité de 95% (100% si > 720 nmol/l).
Il est important d’exclure les causes de faux positifs (ex. inflammation, diabète, tumeur).
Certains animaux avec un syndrome de Cushing ne sont pas détectés par ce test (20-30% voire plus en cas d’hypercorticisme surrénalien essentiellement observé chez les grandes races).
Ce test permet aussi de déceler un syndrome de Cushing iatrogène (cortisolémie effondrée).
En cas de résultat douteux ou négatif, avec une présentation clinique très évocatrice, un test de freination à la dexaméthasone faible dose peut être réalisé.
Remarque : il est important de ne pas administrer d’autres glucocorticoïdes que la dexaméthasone avant le test (interférence avec la cortisolémie endogène mesurée). Si c’est le cas, ils doivent être arrêtés graduellement au moins 36-48h avant.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
2 prélèvements : T0 (avant ACTH), T1 (après 1h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Diagnostic du syndrome d’Addison avec stimulation à l’ACTH (5 µg/kg IV ou IM – mesure à T0 et T+1h) :
Une cortisolémie basale > 55 nmol/l exclut un syndrome d’Addison à 100%.
Une cortisolémie basale effondrée et une absence de réponse à la stimulation (T0 et T+1h < 55 nmol/l) sont en faveur d’un syndrome d’Addison. Un syndrome de Cushing iatrogène ou un traitement de syndrome de Cushing (surdosage) peuvent aussi engendrer de tels résultats.
Remarque : il est important de ne pas administrer d’autres glucocorticoïdes que la dexaméthasone avant le test (interférence avec la cortisolémie endogène mesurée). Si c’est le cas, ils doivent être arrêtés graduellement au moins 36-48h avant.
Les anomalies biochimiques typiques sont une hyperkaliémie et une hyponatrémie. Toutefois, certains animaux peuvent présenter un syndrome d’Addison atypique avec une déficience en glucocorticoïde seule qui ne s’accompagne pas d’anomalie électrolytique (évolution possible vers un hypocorticisme classique avec une déficience conjointe en minéralocorticoïde).
Si des changements électrolytiques sont constatés, un ratio Na/K < 24 est 100% spécifique d’un syndrome d’Addison.
Les anomalies hématologiques souvent associées sont : une anémie non régénérative (Ht 20-35%), une hémoconcentration, une lymphocytose, une éosinophilie, et une absence de formule de stress. Si une lymphocytose est présente, son intensité permet de prédire la probabilité d’un syndrome d’Addison : 90% de spécificité si la lymphocytose est > 2.2 x 10^3 /µl (presque 100% de spécificité au-delà de 5.0 x 10^3 /µl).
Les autres anomalies biologiques souvent observées sont une azotémie, une densité urinaire basse, une hypoglycémie, une hyperphosphatémie, etc.
Le suivi biologique du traitement repose sur la mesure régulière du Na et K (avec correction des autres anomalies hémato-biochimiques).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
2 prélèvements : T0 (avant ACTH), T1 (après 1h)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Le suivi du traitement au Trilostane repose principalement sur la réponse clinique et la cortisolémie mesurée 1h après stimulation à l’ACTH (5 µg/kg IV)
– Après 10 j de traitement :
Suivi clinique, urée, créatinine, ionogramme et test de stimulation à l’ACTH pour écarter un hypocorticisme iatrogène.
1/ Si aucun signe d’hypocorticisme (avec cortisolémie T+1h > 40 nmol/l) : poursuivre le traitement sans modifier les doses durant le premier mois.
2/ Si présence de signes d’hypocorticisme (ou si cortisolémie T+1h < 40 nmol/l) : diminuer ou interrompre le traitement. Un nouveau contrôle est recommandé 10 j après la reprise du traitement (faibles doses).
– Après 1 mois de traitement (puis à 3 mois et tous les 3-6 mois) :
1/ Valeur T+1h souhaitée : entre 40 et 150 nmol/l avec une bonne réponse clinique.
2/ Si la valeur T+1h est entre 40 et 150 nmol/l avec des signes d’hypercorticisme, un traitement biquotidien (matin/soir) peut être envisagé afin d’augmenter la durée d’action du Trilostane, suivi d’un contrôle 10 j plus tard.
3/ Si la valeur T+1h est < 40 nmol/l sans signes d’hypocorticisme, il est recommandé de suspendre le traitement durant 5-7 j, puis de diminuer les doses (ex. 25-50%), et de contrôler 10 j plus tard.
4/ Si la valeur T+1h est < 40 nmol/l avec des signes cliniques d’hypocorticisme, il est recommandé d’interrompre le traitement durant 2-4 semaines (+ dosage des électrolytes et créatinine plasmatiques). Un contrôle est recommandé 10 j après la reprise du traitement (faibles doses).
5/ Si la valeur T+1h est < 40 nmol/l avec des signes cliniques d’hypercorticisme, il est recommandé de revoir le diagnostic initial ou de rechercher une comorbidité pouvant expliquer la persistance des signes cliniques.
6/ Si la valeur T+1h est > 150 nmol/l sans signes d’hypercorticisme, le traitement peut être poursuivi sans changement (un contrôle clinique régulier est néanmoins recommandé).
7/ Si la valeur T+1h est > 150 nmol/l avec des signes d’hypercorticisme (PU/PD et polyphagie), une augmentation des doses (ex. 25-50%) peut être envisagée suivie d’un contrôle 10 j plus tard.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Des concentrations élevées en cortisol sont compatibles avec un syndrome de Cushing, toutefois, des fluctuations (pluriquotidiennes) sont fréquentes chez les chevaux sains ou malades. La cortisolémie est également 30% plus élevée le matin que sur le reste de la journée. Ces variations compliquent l’interprétation de la cortisolémie basale.
Un test de suppression à la dexaméthasone (T0 le soir – avant injection – puis T1 le matin) peut aussi être utilisé, avec une précision diagnostique proche de la mesure de l’ACTH.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Eviter la période post-prandiale
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
L’IGF-1 est un polypeptide synthétisé par le foie, analogue de l’insuline, dont les principaux effets sont l’augmentation de la synthèse protéique, la prolifération et la différenciation cellulaire, la chondrogénèse et la croissance.
– Une valeur augmentée sera en faveur d’une acromégalie (à l’origine d’une insulinorésistance, en particulier chez le chat).
– Une valeur diminuée est compatible avec un nanisme hypophysaire.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Eviter la période post-prandiale
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
En cas d’insulinome canin, l’insulinémie peut se situer dans les valeurs usuelles (ce qui reste inapproprié face à une hypoglycémie avérée) ou être augmentée (le plus souvent).
Il est recommandé d’effectuer la mesure de l’insuline et du glucose à jeun (à distance de toute administration de glucose ou médicament hyperglycémiant dont les stéroïdes). L’hémolyse peut affecter le dosage (fausse diminution).
Le dosage de la fructosamine est aussi un bon indicateur d’une hypoglycémie chronique puisqu’il reflète la glycémie moyenne des 7-15 derniers jours. Plusieurs études montrent que les animaux atteints d’insulinome ont effectivement une concentration plasmatique de fructosamine diminuée. Ce paramètre est également utile en suivi de traitement.
Conditions de prélèvement :
Sérum (tube sec)
Cheval au pré ou nourri avec une petite quantité de foin peu riche en sucres (trempé), n’ayant pas reçu de concentrés dans les 4-6 heures précédentes. Éviter le stress (transport, changement alimentaire …), la douleur (fourbure).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Le dérèglement de l’insuline (DI) inclut toute combinaison d’hyperinsulinémie basale (au repos), d’hyperinsulinémie postprandiale (en réponse à un test d’absorption de glucose ou à un repas) ou d’insulinorésistance. Le DI est le point central du syndrome métabolique équin (SME) et est typiquement associé à de l’obésité. Il peut également s’observer chez des chevaux SME non-obèses ou chez des chevaux non-SME (par exemple lors de dysfonctionnement de la pars intermedia pituitaire – PPID/Cushing ou de façon transitoire lors de maladie systémique, stress, gestation…). Il prédispose au développement d’une fourbure endocrinienne.
Une hyperinsulinémie basale est un critère spécifique pour diagnostiquer un dérèglement de l’insuline mais cette mesure est peu sensible (elle n’identifie que les formes sévères). Elle peut être affectée par le stress, la douleur, l’alimentation (teneur en carbohydrates du fourrage), la saison (valeurs plus élevées en hiver)…
Les valeurs de référence ci-dessous sont données pour un animal recevant un foin pauvre (concentration basse en carbohydrates non structuraux).
Si < 31 µUI/mL : résultat non diagnostique, des tests dynamiques* sont recommandés (test au glucose/sucre ou test de résistance à l’insuline).
Si 30-75 µUI/mL : dérèglement de l’insuline suspecté (à confronter aux signes cliniques), des tests dynamiques* sont recommandés pour mieux évaluer l’animal.
Si > 75 µUI/mL : dérèglement de l’insuline confirmé, prise en charge nécessaire.
N.B : si une maladie de Cushing est confirmée, son traitement est prioritaire car il peut permettre à lui seul de réguler la sécrétion d’insuline.
*Tests dynamiques : se référer aux recommandations de l’Equine Endocrinology Group 2022 « Recommendations for the Diagnosis and Management of Equine Metabolic Syndrome »
Test au glucose :
Après un jeûne d’une nuit, administrer 1 g/kg de sucre dans le repas ou par sondage nasogastrique. Le sucre peut aussi être mélangé à de l’eau bouillante à raison d’environ 30 ml d’eau pour 100 g de glucose. Ce « sirop » peut ensuite être administré oralement à l’aide d’une seringue doseuse (volume total compris entre 200 et 400 ml environ). Le prélèvement de sang est réalisé 2 heures après, pour un dosage de la glycémie et de l’insulinémie.
Le test est valide et l’absorption adéquate si le pic de glucose est supérieur à 8 mmol/l (ou 1,44 g/l). Le test est positif si la valeur d’insuline est supérieure à 85 μU/ml.
Test au sucre (sirop de maïs) :
Après un jeûne de 3 à 8 heures, administrer 15 ml/100 kg de sirop (généralement 30 à 60 ml au total). Le prélèvement de sang est réalisé à 60 et à 90 minutes pour le dosage de la glycémie et de l’insulinémie. Le test est positif si la valeur d’insuline est supérieure à 60 μU/ml. Le test douteux si la valeur d’insuline supérieure à 45 μU/ml.
Test de réponse à l’insuline (évaluation de la résistance à l’insuline) :
Il consiste à mesurer la glycémie avant et 30 minutes après l’injection d’un bolus d’insuline à 0,1 UI/kg. Les chevaux sains présenteront une diminution de plus de 50 % du taux de glycémie plasmatique initial 30 minutes après l’administration de ce bolus. Le test est positif lorsque la baisse de la glycémie est inférieure à la moitié de la valeur basale. Étant donné que les chevaux sains peuvent présenter une hypoglycémie 30 à 90 minutes après l’injection d’insuline, il est important de mettre en place une étroite surveillance lors de la réalisation de ce test.
Alternative : du glucose (150 mg/kg) est injecté sous la forme de glucose à 50 % (30 ml/100 kg), suivi d’une injection d’insuline (0,1 UI/kg). Des prélèvements fréquents, pour mesurer la glycémie et l’insulinémie, sont réalisés pendant 2 à 3 heures. Une version simplifiée du test consiste à ne mesurer la glycémie qu’après 45 minutes (la réponse normale doit permettre un retour à la valeur initiale) et l’insulinémie à 75 minutes (réponse normale inférieure à 100 mU/l).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
– Cycle :
Pro-oestrus et oestrus : 50 à 200 pmol/l ; metoestrus : 35 pmol/l; anoestrus : < 35 pmol/l
– Gestation :
Valeur basale à basse pendant les 6 premières semaines, augmentation en fin de gestation
– Pathologies :
Valeur élevée associée à certaines tumeurs ovariennes (comme certaines tumeurs testiculaires)
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
– Femelle stérilisée ou en anoestrus : < 35 pmol/L
– Oestrus ou fin de dioestrus : 50 à 150 pmol/L
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
– Jument :
> 150 pmol/L : oestrus ; > 300 pmol/L : gestation de plus de 5 mois
– Etalon :
Entre 80 et 150 pmol/l (hongre : < 100 pmol/l)
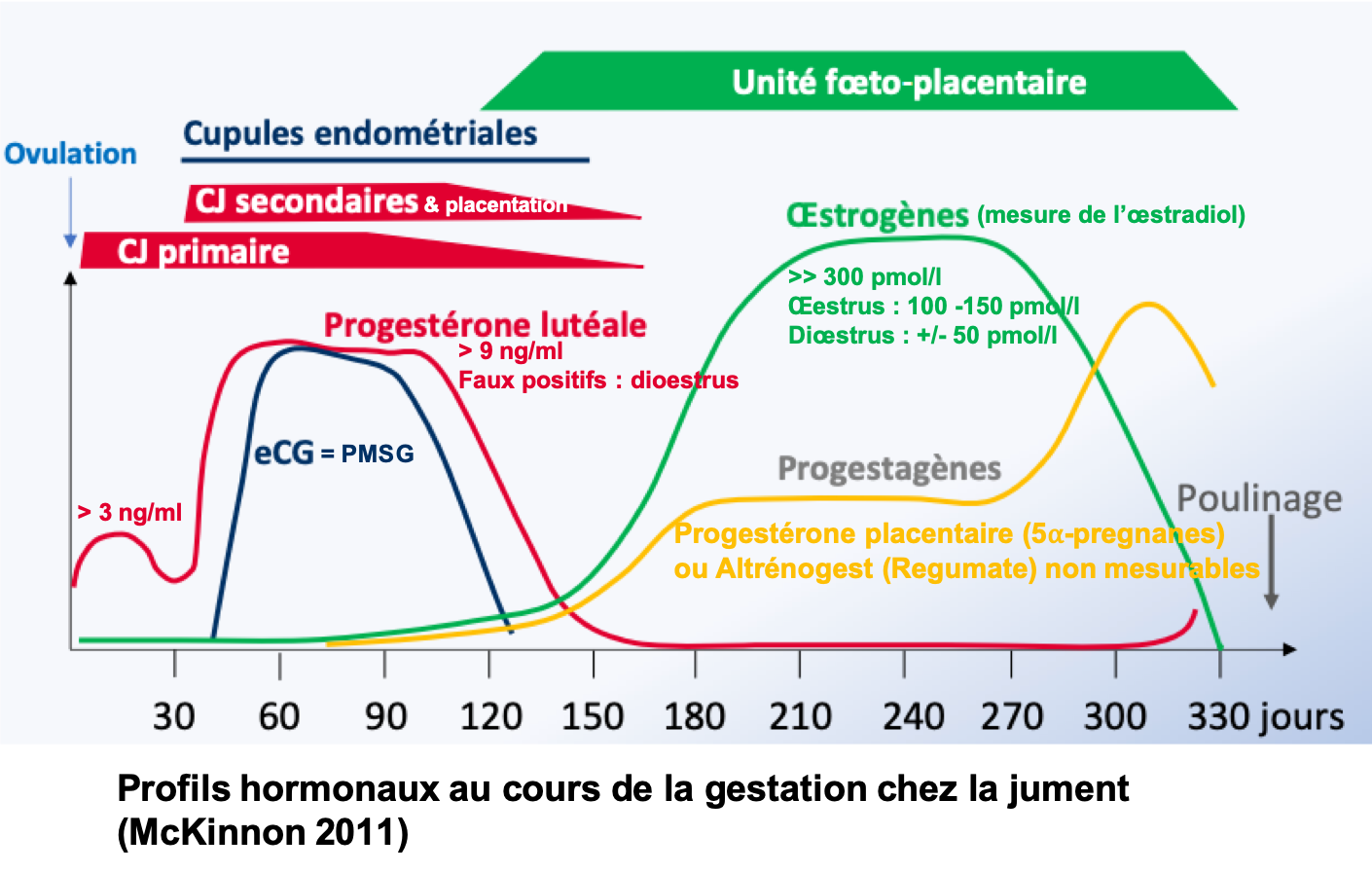
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PMSG (Pregnant Mare Serum Gonadotrophin) ou eCG (Equine Chorionic Gonadotrophin) est une hormone secrétée par les cupules endométriales de la jument pendant la première moitié de la gestation. Elle est présente dans le sang à partir du 40ème jour, atteint un pic autour de 60 jours, puis diminue pour disparaitre vers 100-150 jours.
– PMSG < 0.25 UI/mL : absence de gestation (faux négatifs possible si échantillons < 45 ou > 90 jours)
– 0.25 < PMSG < 1 UI/mL : douteux (refaire un dosage autour de 60 jours de gestation après la date de saillie)
– PMSG > 1 UI/mL : début de gestation (faux positifs possibles en cas de mortalité embryonnaire)
Etant donné que la PMSG ne donne aucune indication sur la viabilité foetale, un dosage de l’oestradiol est recommandé après 100 jours de gestation.
La technique utilisée ne permet pas de doser la PMSG chez l’ânesse.

Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
– Cycle :
Pro-oestrus : environ 2 ng/ml
Oestrus : 4 à 10 ng/ml
Ovulation : 8 à 10 ng/ml
Metoestrus : > 15 ng/ml (et diminution progressive pendant 10 semaines si non gestante)
Anoestrus : < 1 ng/ml
Mise bas imminente : < 2ng/ml
– Gestation :
Pas de différence notoire entre la progestéronémie d’une chienne gestante et celle d’une chienne en metoestrus (mais chute brutale de la progestérone en fin de gestation).
– Rémanence ovarienne :
1er prélèvement dès l’apparition des pseudo-chaleurs, injection d’hCG (Chorulon, 50 UI/kg, IM) et 2ème prélèvement 7-10 jours plus tard (valeur élevée si positif).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
– Anoestrus : < 1 ng/ml
– Ovulation et met-dioestrus : > 3 ng/ml
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Le dosage de la progestérone permet avant tout d’écarter une gestation de moins de 5 mois :
– < 1.5 ng/mL entre 20 jours et 150 jours post saillie : exclusion d’un début de gestation (< 5 mois)
– > 4 ng/mL : compatible avec une gestation ou un corps jaune sécrétant (pic ou une mortalité embryonnaire
– > 9 ng/mL : en faveur d’une gestation entre 5 semaines et 5 mois (faux-négatifs et faux-positifs possibles); le pic de progestérone en phase dioestrale d’une jument cyclée atteint parfois 10-12 ng/mL

Conditions de prélèvement :
Collecte par cystocentèse ou miction naturelle. Il est recommandé de faire récolter l’urine à la maison pour limiter le stress (et au moins 2 jours après la visite chez le vétérinaire).
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Un syndrome de Cushing peut être exclu lorsque la valeur du RCCU est inférieure à 20.0 x 10^-6. Au-delà de cette valeur, il est très difficile de conclure (nombreux faux positifs, ex. diabète). Néanmoins, un syndrome de Cushing est très probable si le RCCU est > 100 x 10^-6.
Un test de freination à la dexaméthasone faible dose ou un test de stimulation à l’ACTH peut être envisagé, si votre suspicion clinique persiste.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
1/ Une valeur élevée de T4 permet généralement de confirmer une hyperthyroïdie. Dans quelques cas (+/- 5% des chats), la T4 peut être augmentée avec des pathologies extra-thyroïdiennes.
2/ Une valeur » normale-haute » de T4 ne permet pas d’exclure une hyperthyroïdie si la présentation clinique est évocatrice. La T4 reste dans les normes (hautes) chez environ 15% des chats hyperthyroïdiens.
Ceci peut s’expliquer par une forme débutante ou légère d’hyperthyroïdie. Une comorbidité (ex. diabète, IRC, MICI) et certaines médications (corticoïdes, TMS, AINS) peuvent aussi abaisser la T4. Un suivi est alors recommandé après traitement éventuel (si possible) des comorbidités, et/ou interruption des médications pouvant abaisser la T4.
NOTE : sur des situations équivoques, il a été montré que la TSH canine (cTSH) peut être mesurée : une valeur effondrée pourra renforcer la suspicion d’une hyperthyroïdie (30% des chats euthyroïdiens ont toutefois une TSH non mesurable).
3/ Une valeur » normale-basse » ou diminuée permet généralement d’exclure une hyperthyroïdie. Certaines pathologies extra-thyroïdiennes (ex. diabète, IRC, MICI) ou médications (corticoïdes, TMS, AINS) peuvent causer une chute de la T4 (sans engendrer d’hypothyroïdie clinique).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
1/ Une valeur normale de T4 et de TSH permettent d’écarter une hypothyroïdie.
2/ Une valeur diminuée de T4 et une valeur élevée de TSH permettent de diagnostiquer une hypothyroïdie. Dans de rares cas, le TMS (voire le phénobarbital et une maladie extra-thyroïdienne) peuvent entraîner les mêmes variations sur la T4/TSH.
3/ Une valeur diminuée de T4 et une valeur normale de TSH ne sont pas en faveur d’une hypothyroïdie. La T4 diminuée peut être associée à d’autres pathologies extra-thyroïdiennes (endocriniennes ou inflammatoires par exemple) ou à certaines médiations (ex. corticoïdes, AINS, phénobarbital, TMS). Chez certaines races, la T4 peut également être physiologiquement plus basse (Greyhounds, Irish Wolfhounds, Sloughis, Salukis, etc.).
Il faut toutefois noter que 30% des chiens hypothyroïdiens peuvent avoir une TSH dans les normes. Un suivi est alors recommandé si la suspicion clinique persiste.
4/ Une valeur normale de T4 et une valeur augmentée de TSH peuvent s’observer dans de rares situations : hypothyroïdie débutante ou subclinique, effet rebond après l’arrêt d’une médication « suppressive » (ex. corticoïdes, AINS, etc.) ou après une maladie non-thyroïdienne, interférence avec des anticorps anti-T4 surestimant le dosage de la T4 (< 2% des chiens hypothyroïdiens). Un suivi est alors recommandé si la suspicion clinique persiste.
5/ Dans de rares cas, une valeur élevée de T4 peut s’observer (en dehors d’une conséquence iatrogène) : interférence avec des anticorps anti-T4 surestimant le dosage de la T4 (< 2% des chiens hypothyroïdiens) ou carcinome thyroïdien sécrétant de la T4 (10% de ces tumeurs sont sécrétantes).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Un suivi est recommandé 3 semaines après le début du traitement, puis tous les 3-6 mois. La valeur attendue (T4 totale) se situe entre 15 et 35 nmol/l (3-5h après le traitement – une étude a aussi montré que la mesure peut être réalisée à n’importe quel moment de la journée par rapport à la prise du médicament).
Certains effets toxiques directs peuvent s’observer durant les 3 premiers mois : une dermatite cervico-faciale, des vomissements/diarrhée/anorexie, une hépatotoxicité, myélotoxicité, une myasthénie grave.
Il est important surveiller la fonction rénale tout au long du traitement. Le pronostic est globalement moins bon lorsqu’une azotémie est déjà présente au moment du diagnostic de l’hyperthyroïdie.
L’hyperthyroïdie peut masquer une maladie rénale chronique, qui peut être révélée par la mise en place du traitement (dans 15-25% des cas). Il est toutefois recommandé de traiter l’hyperthyroïdie (également dommageable pour les reins), même chez des chats en stade II « stable » de MRC (IRIS). L’azotémie peut progresser légèrement suite au traitement, sans impact clinique et pronostique significatif. Si la fonction rénale se détériore, le traitement de l’hyperthyroïdie pourra être ajusté.
Dans tous les cas, une hypothyroïdie iatrogène prolongée doit être évitée (facteur pronostique négatif). Chez des chats azotémiques avec une T4 basse, un surdosage peut être confirmé par une valeur élevée de cTSH.
L’une des applications les plus pertinentes de la SDMA dans le cadre d’une maladie concomitante non rénale est son usage pour le dépistage d’une néphropathie chronique chez le chat hyperthyroïdien sans azotémie. Une étude montre qu’une valeur de SDMA supérieure à 10 μg/dl lors du diagnostic d’hyperthyroïdie chez le chat a une sensibilité de 79 % et une spécificité de 85 % pour le dépistage d’une néphropathie contemporaine, ne se manifestant pas nécessairement par une augmentation de la créatinine avant la prise en charge de l’hyperthyroïdie.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Un suivi est recommandé 4-8 semaines après le début du traitement puis 1-2 fois par an selon la réponse clinique.
Valeur de T4 totale attendue :
– Avant traitement > 10 nmol/l
– 3 à 5 heures après traitement > 17 nmol/l (et < 40 nmol/l)
Si la TSH est mesurée, une valeur normale-basse devrait être observée.
Remarque : les chiens semblent particulièrement résistants aux effets toxiques d’une supplémentation en T4. En cas de surdosage (T4 libre > 90 nmol/l), les signes de toxicité disparaissent quelques jours après l’arrêt ou la diminution du traitement.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Les maladies thyroïdiennes (en hypo ou en hyper) sont extrêmement rares chez les chevaux adultes, alors que l’hypothyroïdie congénitale peut occasionnellement être détectée chez les poulains. Les valeurs des hormones thyroïdiennes peuvent varier en fonction de nombreux facteurs : âge, sexe, saison, heure de la journée, alimentation, médicament, exercice, transport, stress, maladies…
Une valeur basse en hormones thyroïdiennes ne permet pas de conclure à une hypothyroïdie, d’autres tests peuvent être nécessaires (en particulier un test de stimulation à la TRH).
Une valeur deux à trois fois plus élevée en hormones thyroïdiennes, associée à des signes cliniques évocateurs, est en faveur d’une hyperthyroïdie. Un examen échographique de la glande thyroïdienne est alors recommandé.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Chien mâle entier (sain) : valeur basale 5 – 15 nmol/L et > 25 nmol/L après stimulation à l’hCG (Chorulon MSD, 50 UI/kg IM)
Chat mâle entier (sain) : valeur basale 15 – 25 nmol/L et > 45 nmol/L après stimulation à l’hCG (Chorulon MSD, 50 UI/kg IM)
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
La testostéronémie basale varie d’heure en heure et selon la saison. Une valeur basale élevée (sans stimulation) est compatible avec la présence de tissu testiculaire (surtout évident durant la période de reproduction). Une valeur basale faible est difficile à interpréter (en particulier en Novembre/Décembre) et nécessite souvent une 2ème mesure de la testostéronémie après stimulation à l’hCG (1-2h après ou idéalement 24-48h après | Chorulon MSD, IM, 25 UI/kg, Max : 15000 UI/cheval).
– Cheval mâle :
Valeur après stimulation comprise entre 25 et 40 nmol/L : normal ou cryptorchide (cortisolémie basale et post-stimulation souvent plus faible chez les cryptorchides)
Valeur après stimulation < 23 nmol/L : hypogonadisme
Valeur après stimulation > 40 nmol/L : hypertestostéronémie
– Hongre :
Valeur < 1 nmol/L et pas de réponse à la stimulation hCG
– Jument :
Valeur < 1 nmol/L
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La sensibilité du dosage de TLI est proche de 100% en dessous du seuil de 2,5 µg/L et la spécificité est proche de 100% au-delà du seuil de 5 µg/L. Pour les valeurs intermédiaires situées entre 2,5 et 5 µg/L, il peut s’agir d’une IPE débutante ou subclinique qui nécessite une nouvelle mesure (à jeun – 4 semaines plus tard), notamment chez les races prédisposées (Bergers Allemands et races apparentées, Chow Chow, Eurasier, Terre Neuve).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
1/ TSH normale : hypothyroïdie peu probable. Cependant, jusqu’à 30% des chiens hypothyroïdiens peuvent avoir une TSH dans les normes.
2/ TSH élevée : hypothyroïdie très probable. Dans certains cas, une maladie extra-thyroïdienne ou certaines médications (ex. TMS ou phénobarbital) peuvent causer une augmentation de la TSH sans hypothyroïdie. Pour diminuer ce risque de faux positifs associé à une mesure isolée de la TSH (7-18% selon les études), il est recommandé de doser conjointement la T4 libre/totale (< 2% de faux positifs dans ce cas).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement sur animal de préférence à jeun depuis 12 heures
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Une baisse de la vitamine B12 peut être due à une malabsorption chronique de la vitamine B12, secondaire à un dommage pancréatique, gastrique ou iléale (dont tumeurs et MICI).
La prolifération de certaines bactéries intestinales peut aussi causer une baisse de la vitamine B12 (surconsommation).
La recommandation actuelle est d’envisager une supplémentation chez tous les chiens dont la cobalaminémie est basse ou suboptimale (dans la moitié inférieure de l’intervalle de référence). Il n’y a aucune preuve de toxicité en cas de sursupplémentation.
Protocoles de supplémentation en cobalamine chez le Chien :

Spécialités disponibles pour la supplémentation en cobalamine :

Médicaments
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Le moment importe peu par rapport à la prise du médicament
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Lorsque le bromure est associé au phénobarbital, des bromémies comprises entre 0,7 et 2,5 g/L ont été prouvées comme efficaces alors qu’utilisé seul, il faut parfois atteindre des concentrations jusqu’à 3 g/L.
Du fait de sa demi-vie longue (de plus de 15 à 20 jours), la prise de sang de contrôle de la bromémie peut être effectuée n’importe quand dans la journée en évitant toutefois de la réaliser dans les deux heures suivant la prise de manière à éviter un pic de concentration.
Le premier contrôle de bromémie est conseillé 6 à 12 semaines après la mise en place du traitement puis sur une base annuelle à moins que l’animal présente plus de 3 crises avant le prochain contrôle ou si des effets secondaires (sédation principalement) sont suspectés.
Les effets secondaires rapportés avec l’utilisation du bromure sont une ataxie des membres postérieurs, une faiblesse et une baisse de vigilance. Ces effets sont le plus souvent observés quand la bromémie dépasse 3 g/L. Le bromure étant éliminé par voie rénale, cette concentration peut plus facilement être atteinte chez des animaux présentant une maladie rénale chronique.
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Il est recommandé de réaliser la prise de sang 8 à 12 heures après la prise de digoxine.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
L’intervalle des concentrations recherchées est étroit et compris entre 0,8 et 1,2 ng/mL (des effets secondaires peuvent être observés dès ces concentrations, en particulier si l’animal est hypokaliémique ou insuffisant rénal).
Le premier contrôle de la digoxinémie est recommandé 3 à 5 jours après la mise en place du traitement puis tous les 3 à 6 mois.
Les signes de toxicité sont digestifs (anorexie, diarrhée, vomissement, nausées), neurologiques (somnolence), et cardiaques (tachycardies ventriculaires et/ ou extrasystoles ventriculaires isolées notamment).
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec)
Prélèvement 3-5 h après le traitement
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Les valeurs attendues au cours du traitement se situent entre 15 et 40 mg/L, toutefois, la majorité des animaux sont bien stabilisés avec des valeurs comprises entre 10 et 20 mg/L.
Fréquence du suivi thérapeutique : 3 semaines après le début du traitement (équilibre thérapeutique atteint) puis tous les 6 mois. En cas de changement de la dose thérapeutique (persistance des crises ou à l’inverse présence d’effets indésirables/toxiques), un contrôle 3 semaines plus tard est recommandé.
A des doses thérapeutiques classiques, peuvent survenir des effets indésirables comme une polyphagie accompagnée d’une polydipsie et d’une polyurie, un effet hypnotique et une faiblesse des membres postérieurs avec ataxie. Ces troubles régressent en une à deux semaines. Lorsqu’ils sont marqués, une diminution de la dose est à envisager.
Une intoxication hépatique peut survenir à 45 mg/L (à explorer par une biochimie hépatique avec une mesure des sels biliaires à jeun et 1 heure après le repas). L’administration du phénobarbital peut aussi avoir un effet délétère sur la moelle osseuse : une pancytopénie ou, plus souvent, une neutropénie d’origine immunotoxicologique. Ces deux effets régressent après l’arrêt de l’administration de phénobarbital.
Urologie
Oxalate de calcium :
La formation des calculs d’oxalate de calcium dépend de nombreux facteurs, notamment : hypercalciurie, diurèse faible (concentration élevée en solutés), prédisposition génétique.
Si une hypercalcémie est présente, il est important d’en déterminer la cause.
En l’absence d’hypercalcémie, il est recommandé de favoriser la diurèse, diminuer la calciurie et au besoin d’alcaliniser l’urine, en veillant à apporter une alimentation réduite en calcium, sodium et oxalate.
En cas d’obstructions récidivantes, la cystotomie ou l’hydropulsion peuvent être envisagées.
Struvite :
La formation des struvites est favorisée par une infection urinaire, un pH urinaire alcalin et un régime alimentaire déséquilibré. Il existe également une prédisposition génétique.
Parmi les mesures diététiques correctrices, un apport réduit en magnésium, phosphore et protéines est recommandé. Les urines peuvent être acidifiées (méthionine).
En cas d’échec de traitement médical, l’hydropulsion ou la cystotomie peuvent être envisagées.
Cystine :
Ce type de calcul est plus fréquent chez le mâle et lors d’acidurie. Certaines races sont également prédisposées (ex. Teckel).
Un régime pauvre en protéine et alcalinisant est généralement recommandé. Si besoin, les urines peuvent être alcalinisées.
La synthèse de cystine peut être inhibée par la tiopronine (ACADIONE) et la pénicillamine peut permettre de dissoudre les calculs.
En cas de récidives : cystotomie ou hydropulsion recommandée.
Phosphate de calcium :
Ce type de calcul est rarement pur (souvent mixte avec prédominance de struvite ou d’oxalate de calcium). Les causes favorisantes incluent une hypercalciurie, une hyperphosphaturie et une urine alcaline (ex. secondaire à une infection urinaire).
Un apport réduit en calcium, protéines et vitamines D est recommandé, tout en favorisant la diurèse.
En cas d’obstructions récidivantes, la cystotomie ou l’hydropulsion peuvent être envisagées.
Urates :
Certaines races sont prédisposées, sans autre pathologie concomitante : Dalmatien, Bulldog anglais notamment. Certains chats sains peuvent aussi présenter ce type de calcul.
Ils peuvent aussi être observés en cas de shunt vasculaire portosystémique et de maladies hépatiques sévères.
Outre le traitement d’une éventuelle atteinte hépatique, un apport réduit en purine (éviter les abats) et en protéines est recommandé, tout en favorisant la diurèse et un pH urinaire plutôt alcalin. L’ Allopurinol peut être utilisé chez le Dalmatien.
En cas d’obstructions récidivantes, la cystotomie ou l’hydropulsion peuvent être envisagées.
Comment ?
– La cystocentèse échoguidée (chiens et chats) permet d’obtenir un prélèvement de très bonne qualité. Le principal avantage est de prévenir la contamination des urines par les voies urinaires et génitales, donc la réalisation de prélèvements stériles pour l’examen bactériologique.
La cystocentèse est, en revanche, fréquemment à l’origine d’une contamination sanguine des urines prélevées.
– La récolte par miction spontanée permet le plus souvent d’obtenir un prélèvement de qualité. Les urines sont recueillies dans un contenant propre du type barquette à usage unique. Les urines sont idéalement récoltées après un lavage des voies uro-génitales externes de l’animal (eau du robinet sans savon/antiseptique) et une éventuelle coupe ou tonte des poils dépassant des voies externes. Les premiers jets doivent, si possible, être exclus.
– Le sondage ne doit pas être utilisé pour la réalisation d’une simple analyse d’urine chez le chien ou le chat. Les risques traumatique et infectieux pour l’animal sont en effet importants. Le prélèvement est généralement de qualité inférieure à celui qui est obtenu par les autres méthodes (nombreux débris, cellules épithéliales, hémodilution, contamination bactérienne, voire fongique, etc.).
Où (chiens et chats) ?
Le RPCU mesuré sur des urines obtenues à la clinique est supérieure à la valeur mesurée sur celles récoltées au domicile de l’animal (stress). Cette surestimation est plus forte chez les chiens protéinuriques versus non protéinuriques. La valeur du rapport cortisol sur créatinine urinaires (RCCU) est également augmentée sur des urines récoltées à la clinique, pouvant amener à de faux positifs.
Quand (chiens et chats) ?
La prise d’un repas récent est une cause d’alcalinisation des urines. La densité urinaire est plus élevée sur les premières urines du matin que sur un autre prélèvement pendant la journée. La capacité ou non d’un animal à concentrer ses urines est donc mieux évaluée sur les urines du matin. Pour le RCCU, il est recommandé de récolter les urines du matin 2 à 3 jours de suite pour limiter l’effet des variations journalières et au moins 2 jours après une visite chez un vétérinaire pour limiter l’effet du stress. En revanche, le RPCU n’est pas significativement affecté par le moment de collecte de l’urine.
Conservation :
4°C (cristallisation d’oxalates de calcium néanmoins favorisée) et à l’abri de la lumière jusqu’à l’envoi.
Densité urinaire
La densité urinaire, qui est une estimation de l’osmolalité urinaire, permet d’évaluer la capacité du rein à concentrer ou à diluer les urines. L’interprétation des résultats de la bandelette urinaire ou des constituants du sédiment urinaire nécessite de connaître la densité urinaire de l’animal.
Les premières urines du matin sont à privilégier pour la mesure de la densité urinaire.
Une densité urinaire basse observée de manière récurrente chez un animal normalement hydraté ou encore la production d’urines diluées chez un animal déshydraté constituent des situations anormales, nécessitant une exploration avec en hypothèse sous-jacente l’ensemble des causes de polyuro-polydipsie. Une densité urinaire > 1.030 chez le chien et > 1.035 chez le chat suggèrent une absence de maladie rénale (sauf si débutante).

Particularités des équidés : en général, un cheval sain a une urine hypersthénurique (c’est-à-dire > 1,014). S’il est nourri au foin, la densité urinaire varie entre 1,025 et 1,040, alors que s’il est au pré et à l’herbe, elle peut être plus basse. On considère qu’un cheval conserve sa capacité à concentrer l’urine lorsque la densité urinaire est > 1,025. En cas de maladie rénale, la densité urinaire est typiquement < 1,025 (avec une azotémie ou une augmentation concomitante de la SDMA).
pH
L’intervalle des valeurs physiologiques du pH chez le chien et le chat s’étend de 4,5 à 8,5.
Le pH urinaire est très variable et dépend, entre autres, du statut acidobasique de l’animal, de son régime alimentaire, de la prise d’un repas récent, d’une éventuelle infection du tractus urinaire. Les régimes plus riches en protéines sont associés à un pH urinaire plus acide, c’est pourquoi les carnivores ont un pH urinaire généralement plus bas que les herbivores. La prise récente d’un repas amène en revanche à une légère alcalinisation passagère des urines chez les carnivores. La contamination des urines par les désinfectants ou détergents courants (par exemple, l’eau de Javel) peut entraîner un résultat erroné (alcalinurie artéfactuelle). Les infections urinaires à bactéries uréase positives ou un stockage prolongé des urines à l’air libre sont des processus alcalinisants.
Particularités des équidés : l’urine de cheval adulte est normalement alcaline (7,0 à 9,0), alors que celle des poulains est acide. Une acidose métabolique, une acidose rénale tubulaire proximale et, paradoxalement, une alcalose métabolique hypochlorémique peuvent induire une acidité des urines. De nombreux autres facteurs sont à l’origine d’une acidification : un exercice intense, une déshydratation, une infection du tractus urinaire, une anorexie ou un jeûne prolongé.
Protéines
Lors d’alcalinurie marquée, une plage protéines positive peut être artéfactuelle. De même, une contamination des urines par des détergents (ammoniums quaternaires) peut être à l’origine de faux positifs.
Une protéinurie peut être prérénale, rénale, ou postrénale. La protéinurie prérénale est liée au passage de petites protéines au travers du filtre glomérulaire normal (ex. protéines de Bence-Jones lors de myélome multiple, myoglobine lors de rhabdomyolyse, hémoglobine lors d’hémolyse intravaculaire). La bandelette identifie surtout l’albumine et peu les globulines. Les deux principales causes pathologiques de réaction positive de la plage protéines sont donc les protéinuries rénale et postrénale. Une protéinurie rénale est liée à un dysfonctionnement glomérulaire et/ou tubulaire. Une protéinurie postrénale résulte d’une atteinte située sur le tractus uro-génital, sans atteinte des néphrons. Cela peut survenir lors d’une inflammation du tractus uro-génital, d’une hématurie ou d’une spermaturie (faible protéinurie). Lors de protéinurie à la bandelette, il convient donc d’écarter les faux positifs, puis de déterminer si la protéinurie est d’origine rénale ou postrénale, à l’aide de l’examen du culot de centrifugation. Plusieurs études ont montré la très grande sensibilité des bandelettes urinaires pour la protéinurie (excepté pour la protéinurie prérénale), mais aussi sa faible spécificité chez le chien, et encore plus chez le chat.
L’interprétation du résultat doit être interprété en fonction de la valeur de la densité urinaire. Chez le chien :
– Pour toute densité urinaire, un résultat de 0 est généralement négatif et pour une densité urinaire supérieure ou égale à 1,030, un résultat de 1+ à la bandelette, avec un culot inactif, doit être considéré comme négatif et n’appelle pas à la réalisation d’un rapport de la protéinurie sur la créatininurie (RPCU) pour quantifier la protéinurie.
– Pour une densité urinaire inférieure ou égale à 1,012, un résultat de 1+ avec un culot inactif doit être considéré comme potentiellement positif et amener à la réalisation d’un RPCU pour confirmer et quantifier ou exclure la protéinurie.
– Pour toute densité urinaire, un résultat supérieur ou égal à 2+ avec un culot inactif est considéré positif et doit mener à la réalisation d’un RPCU.
Particularités des équidés : les bandelettes urinaires sont peu sensibles et peu spécifiques pour la détection d’une protéinurie. La mesure du RPCU est recommandée.
Glucose
Lors de glucosurie détectée à la bandelette, celle-ci doit être interprétée conjointement à la glycémie de l’animal, les mesures respectives étant réalisées au même moment. La glucosurie peut être associée à une hyperglycémie, traduisant simplement le dépassement de la capacité de réabsorption tubulaire rénale du glucose (environ 1,8 g/l chez le chien et 2,6 à 3 g/l chez le chat). L’hyperglycémie peut être passagère et physiologique (stress, perfusion de glucose), persistante et pathologique (diabète sucré, hypercorticisme, pancréatite, phéochromocytome, acromégalie, sepsis, etc.) ou bien secondaire à une autre cause (toxique [éthylène glycol] ou médicamenteuse [corticoïdes, adrénaline, progestérone, etc.]). Si la glucosurie n’est pas associée à une hyperglycémie, elle signe une atteinte tubulaire rénale. Le diagnostic différentiel comprend alors le syndrome de Fanconi, une tubulopathie acquise (leptospirose chez le chien par exemple, toxicité médicamenteuse) ou bien une glucosurie rénale primaire (basenji, chien d’élan norvégien, shetland).
Particularités des équidés : une glucosurie peut être détectée lors d’une alimentation parentérale avec du glucose, ou à la suite de l’administration d’α2-agonistes ou de corticoïdes. Un cheval peut également présenter une glucosurie en cas de processus pathologique (sepsis, dysfonctionnement de la pars intermedia de la glande pituitaire, diabète, etc.).
Bilirubine
La plage bilirubine des bandelettes urinaires réagit préférentiellement avec la bilirubine conjuguée, plus soluble que la bilirubine non conjuguée. La bilirubine conjuguée est instable et photosensible, pouvant être à l’origine de faux négatifs. Une bilirubinurie, comme une hyperbilirubinémie, peut avoir lieu en cas de production augmentée (hémolyse), d’insuffisance hépatique ou de cholestase intra- ou posthépatique. Il a également été démontré chez le chien une capacité des cellules rénales à conjuguer, puis à excréter la bilirubine, c’est pourquoi une bilirubinurie est fréquemment rapportée chez des animaux sains. Une bilirubinurie pathologique peut précéder une hyperbilirubinémie, mais de façon non systématique, et il est possible d’obtenir un test négatif à la bandelette chez des chiens en hyperbilirubinémie. Chez le chat, la bilirubinurie est toujours pathologique, y compris dans des urines très concentrées.
Activité peroxydasique (sang)
Une plage de la bandelette détecte l’activité peroxydasique de l’hème de l’hémoglobine et de la myoglobine principalement. Ce test est très sensible, donc efficace même sur des urines macroscopiquement normales (non colorées).
Le résultat est positif en cas d’hématurie “vraie” (sang en nature dans les urines), d’hémoglobinurie (en cas d’hémolyse in vivo ou in vitro) et de myoglobinurie. L’examen du culot de centrifugation permet de discriminer entre une hématurie et une pigmenturie (hémoglobinurie ou myoglobinurie). Le reste de l’examen biologique de l’animal (numération et formule sanguines [NF], créatine kinase [CK]) permet de déterminer si une hémolyse ou une lésion musculaire est à l’origine de la pigmenturie. La couleur du plasma est également une indication : un plasma clair suggère une myoglobinurie ou une hématurie, alors qu’un plasma rosé ou rouge évoque une hémolyse intravasculaire. Enfin, lors de faible hématurie (par exemple, liée à une contamination au moment du prélèvement par cystocentèse), il est possible que les hématies, peu nombreuses, soient lysées pendant la centrifugation du culot. Ainsi un résultat positif de la plage activité peroxydasique peut être obtenu, avec des urines non colorées, en l’absence d’hématies au culot et d’anomalie au bilan biologique suggérant une hémolyse ou une rhabdomyolyse.
Corps cétoniques
En conditions physiologiques, le résultat de la bandelette doit être négatif. Les corps cétoniques sont des composants volatils, c’est pourquoi l’analyse de la bandelette doit être réalisée immédiatement après le prélèvement. Les corps cétoniques sont produits à la suite d’une dérive du métabolisme énergétique des cellules, délaissant la glycolyse au profit d’une lipolyse accrue.
Chez les carnivores domestiques, cela survient dans deux situations :
– Un diabète sucré mal contrôlé (acido-cétosique)
– Une anorexie prolongée
Interprétation du dénombrement sur gélose en fonction de la méthode de collecte :
– Cystocentèse : significatif si > 10^3 CFU /ml
– Cathétérisme : significatif si > 10^4 CFU /ml
– Miction naturelle : significatif si > 10^5 CFU /ml
Remarques générales sur les bactéries identifiées :
– Les principales bactéries d’intérêt clinique sont : Escherichia coli, Staphylococcus intermedius, Proteus mirabilis, Enterococcus faecalis, Streptococcus du groupe G et Pseudomonas aeruginosa. Si une autre bactérie est isolée et/ou si plusieurs bactéries différentes sont présentes, une contamination du prélèvement doit être considérée.
– Certaines bactéries uréase-positives favorisent la formation de cristaux/urolithes de struvite : Proteus sp., Pseudomonas sp., Staphylococcus sp. et Klebsiella sp.
– Enterococcus (faecalis et faecium) est parfois isolé, la plupart du temps sans signification clinique, et disparaît sans nécessiter de traitement. Si une autre bactérie est présente, le traitement portera préférentiellement sur celle-ci, même si l’antibiogramme montre un profil multirésistant pour Enterococcus.
– L’usage d’antibiotiques ayant une bonne élimination urinaire est recommandé : ex. pénicilline, amoxicilline, TMS, quinolones.
Démarche thérapeutique lors d’infection urinaire :
Les causes favorisantes d’une infection urinaire incluent : lithiase, tumeur, obésité, maladie rénale, malformations congénitales, diabète sucré, syndrome de Cushing, corticothérapie, prostatite.
– En cas de cystite sporadique (animal en bonne santé, aucune comorbidité ou anomalie anatomique, < 3 épisodes en 12 mois) : 3-5 jours de traitement (ex. amoxicilline ou TMS) débuté si possible après les résultats de la culture bactérienne (AINS dans l’attente).
– En cas de cystite récurrente (> 3 épisodes en 12 mois ou > 2 épisodes en 6 mois) : recherche de comorbidités nécessaire, début de l’antibiothérapie si possible après les résultats de la culture bactérienne (AINS dans l’attente), 3-5 jours de traitement si réinfection par une nouvelle bactérie, 7-14 jours si infection répétée ou persistante avec la même bactérie. Changement d’antibiotique seulement en l’absence d’amélioration clinique et selon les résultats de l’antibiogramme (dans le cas d’une amélioration clinique, même si l’antibiogramme indique une résistance in vitro, le traitement peut être poursuivi). En cas de cystite récurrente, il faut rechercher une guérison clinique plutôt qu’une résolution biologique (la persistance d’une bactériurie subclinique peut être tolérée afin d’éviter une exposition excessive aux antibiotiques).
– Pyélonéphrite (fièvre, léthargie, PUPD, douleurs rénales, azotémie, neutrophilie, etc.) : traitement de 10-14 jours (ex. céfalexine, fluoroquinolones), à adapter selon l’antibiogramme
– Prostatite bactérienne (signes cliniques de cystite chez un mâle entier) : investigations complémentaires (imagerie, lavage, cytologie, etc.), traitement de 4-6 semaines (ex. TMS, quinolones – ou clindamycine/macrolides si sensibilité in vitro à l’antibiogramme) et castration recommandée.
Dans tous les cas de figure ci-dessus, un ECBU de contrôle est recommandé 1 semaine après l’arrêt du traitement.
Cas des bactériuries subcliniques (et sans pyurie) :
– Une bactériurie sans pyurie peut être associée à une contamination de l’échantillon (flore urogénitale externe, prélèvement non stérile, délai d’analyse prolongé).
– Une bactériurie subclinique (et sans pyurie) ne nécessite pas d’antibiothérapie, même si la bactérie est multirésistante. Environ 10% des chiens sains (davantage en cas d’obésité, diabète, Cushing, paralysie, immunosuppresseurs, …) et 20% des chats sains ont une bactériurie subclinique, sans augmentation du risque d’infection urinaire chez ces animaux.
– Si les signes cliniques sont en faveur d’une cystite, ou s’il existe un risque important d’infection ascendante, ou en présence d’une bactérie uréase-positive favorisant la formation de struvites (ex. Proteus, Pseudomonas, Staphylocoques), un traitement de 3-5 jours (ex. amoxicilline ou TMS) peut être réalisé, et adapté selon la réponse clinique et l’antibiogramme.
Erythrocytes
Une hématurie microscopique peut être d’origine iatrogène, liée au mode de prélèvement (cystocentèse ou sondage). Si le prélèvement est réalisé par miction spontanée, l’hématurie est toujours pathologique. Lorsqu’elle est pathologique, l’hématurie peut être de différentes origines, dont :
– les reins (potentiellement associée à la présence de cylindres hématiques)
– le bas appareil urinaire : calculs, inflammation, traumatisme, tumeur
– l’appareil génital : œstrus, maladie prostatique
– des troubles de l’hémostase
Leucocytes
La présence de leucocytes en quantité significative signe l’existence d’une inflammation, qu’elle soit primaire (infection du tractus urogénital) ou secondaire (calculs, traumatisme, tumeur, cyclophosphamide, etc.). Lors d’inflammation secondaire, des cristaux (phosphate ammoniaco-magnésien ou struvites, oxalates, etc.) ou des cellules tumorales, par exemple, peuvent être retrouvés selon la cause.
Cellules épithéliales
Deux types de cellules épithéliales sont distingués :
– Les cellules squameuses, présentes uniquement sur le tiers distal de l’urètre et en regard des voies génitales
– Les cellules urothéliales (urètre proximal, vessie, uretères, bassinet, tubules rénaux)
Ces cellules peuvent être présentes normalement dans les prélèvements réalisés par sondage urinaire.Elles sont aussi observées lors :
– d’inflammation
– de processus néoplasique (carcinome transitionnel), et sont alors associées à des atypies cytonucléaires
– de chimiothérapie au cyclophosphamide
Cylindres
Les cylindres sont des éléments d’aspect rectangulaire qui épousent la forme des tubules rénaux.Il en existe plusieurs types :
– les cylindres hyalins. Ils peuvent être retrouvés chez des individus sains (0 ou 1 par champ au grossissement × 400). Lorsqu’ils sont nombreux (plus de 2 par champ à × 400), ils sont le signe d’une atteinte rénale
– les cylindres granuleux sont constitués de matériel cellulaire dégradé. Ils sont toujours le signe d’une souffrance rénale (incluant la leptospirose). Cependant, l’absence de cylindres granuleux (ou hyalins) ne permet pas d’exclure la possibilité d’une atteinte rénale
– il existe aussi des cylindres érythrocytaires, graisseux ou encore leucocytaires, leur nom dépendant du contenu incorporé au sein de la matrice protéique
Cristaux
– Struvites
Ces cristaux se forment à pH basique ou neutre. Ils peuvent être retrouvés chez des animaux sains en faible quantité, chez des individus présentant des calculs et lors d’infection du tractus urinaire.
– Oxalate
Les cristaux d’oxalate se forment dans les urines neutres ou acides, et éventuellement dans les urines basiques. Ils sont parfois présents en faible nombre chez des animaux sains, mais, en quantité significative, ils sont possiblement associés à des calculs, retrouvés lors d’intoxication à l’éthylène glycol (hyperoxalurie avec surtout des monohydrates) ou d’hypercalciurie.
– Urates d’ammonium
Ils sont retrouvés fréquemment chez le dalmatien et les bouledogues anglais, et lors de maladies hépatiques ou de shunt porto-systémique.
– Bilirubine
Ils peuvent être physiologiques chez le chien, en faible quantité, et observés dans des urines très concentrées. Cependant, présents en quantité importante sur plusieurs analyses d’urines consécutives, ils sont le signe d’une hyperbilirubinurie avec une hyperbilirubinémie (hémolyse, atteinte hépatique, cholestase, etc.). Ils sont toujours pathologiques chez le chat.
– Cystine
Leur formation est toujours pathologique et survient chez des animaux atteints d’une anomalie congénitale caractérisée par un défaut de réabsorption tubulaire de la cystine (bulldog anglais, teckel, chihuahua, bull mastiff). Cependant, les animaux présentant une cystinurie ne développent pas tous des calculs de cystine.
Particularités des équidés :
Des cristaux sont habituellement présents dans l’urine des équidés. Il s’agit principalement de cristaux de carbonate de calcium, bien que des cristaux de phosphate de calcium ou des oxalates puissent également être présents.
Bactéries
La détection de bactéries dans les urines doit conduire à une suspicion d’infection du tractus urinaire si elles sont associées à des leucocytes. Cependant, le mode de prélèvement doit être pris en compte (contamination cutanée lors de miction spontanée ou de défaut d’asepsie). La bactériologie est l’examen de choix pour leur quantification, leur identification et la réalisation d’un antibiogramme.
Autres éléments
– Les globules gras sont fréquents et physiologiques chez le chat.
– Des spermatozoïdes sont parfois observés dans le sédiment urinaire de chiens et de chats mâles non castrés. Ils sont alors le signe d’une éjaculation rétrograde.
– Des contaminants sont également fréquemment observés, avec notamment des bulles d’air, des fibres végétales ou encore des grains de pollen.
Conditions de prélèvement :
Urine (tube sec)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La mutation BRAF V595E permet de diagnostiquer avec une spécificité de 100% un carcinome transitionnel de la vessie ou de la prostate, à partir des cellules du culot urinaire (absence de faux positifs lors de cystite, polype ou tumeur bénigne).
En revanche, la sensibilité varie entre 67 et 87 % (entre 13 et 33% de faux négatifs). Un résultat négatif n’exclut donc pas un carcinome (à confronter alors au contexte clinique et aux autres examens complémentaires).
Ce test permet aussi de détecter une rechute après chimiothérapie à partir du culot urinaire.
Conditions de prélèvement :
Collecte par cystocentèse, cathétérisme ou miction naturelle.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La GGT est également produite par les cellules tubulaires. Si le ratio GGT/créatinine urinaire est élevé, une altération des tubules rénaux peut être suspectée (toxicité médicamenteuse, ischémie, inflammation, leptospirose, etc.).
Conditions de prélèvement :
Collecte par cystocentèse ou miction naturelle. Il est recommandé de faire récolter l’urine à la maison pour limiter le stress (et au moins 2 jours après la visite chez le vétérinaire).
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Un syndrome de Cushing peut être exclu lorsque la valeur du RCCU est inférieure à 20.0 x 10^-6. Au-delà de cette valeur, il est très difficile de conclure (nombreux faux positifs, ex. diabète). Néanmoins, un syndrome de Cushing est très probable si le RCCU est > 100 x 10^-6.
Un test de freination à la dexaméthasone faible dose ou un test de stimulation à l’ACTH peut être envisagé, si votre suspicion clinique persiste.
Conditions de prélèvement :
Collecte par cystocentèse, cathétérisme ou miction naturelle. Le RPCU mesuré sur des urines obtenues à la clinique est supérieure à la valeur mesurée sur celles récoltées au domicile de l’animal (stress). Cette surestimation est plus forte chez les chiens protéinuriques versus non protéinuriques. En revanche, le moment de collecte dans la journée importe peu.
Conservation et stabilité (si envoi différé) : stable pendant 15 jours à +4 °C et 3 jours à température ambiante.
Interprétation :
Le RPCU permet de quantifier/confirmer une protéinurie visible à la bandelette urinaire. Cette protéinurie peut être d’origine rénale (glomérulaire voire tubulaire) ou hémorragique/inflammatoire (ex. pyélonéphrite, cystite, lithiase, tumeur, etc.).
Le RPCU est donc interprété en fonction de l’examen microscopique de l’urine : un RPCU élevé sans inflammation/hématurie significative sera en faveur d’une atteinte rénale.
– Chiens et chats :
Une atteinte glomérulaire est suspectée lorsque le RPCU est > à 2 sur deux ou trois échantillons (en dehors de tout signe d’inflammation du tractus urinaire). Dans les atteintes tubulaires, le RPCU est moins élevé. Exemples d’atteinte glomérulaire : glomérulonéphrite (infections vectorielles, leptospirose, lupus, pancréatite, MICI, néoplasie, Cushing, etc.) et autres glomérulopathies (amyloïdose, néphrites héréditaires, glomérulosclérose, etc.).
Interprétation du RPCU dans le cadre d’une maladie rénale chronique (IRIS) :
< 0,2 chez le chien/chat : non protéinurique
0,2-0,5 chez le chien et 0,2-0,4 chez le chat : protéinurie limite
> 0,5 chez le chien et > 0,4 chez le chat : protéinurique
– Equidés :
Des valeurs entre 0,03 et 0,93 sont rapportées chez des chevaux sains.
Vitamines & oligoéléments
Conditions de prélèvement :
Plasma hépariné ou sérum (tube sec) rapidement séparé et placé à l’abri de la lumière (pour la vitamine E)
Conservation et stabilité : envoi sous 24h si possible réfrigéré sinon congélation à – 20°C (stable plusieurs jours/semaines)
Interprétation :
Le sélénium et la vitamine E (alpha-tocophérol) sont deux puissants antioxydants.
Chez le cheval, leur carence peut entraîner des troubles neuromusculaires sévères (myéloencéphalopathie dégénérative, dystrophie neuroaxonale, maladie du motoneurone, myopathie par déficience en vitamine E…). A contrario, une supplémentation adéquate en sélénium et en vitamine E a été corrélée à une diminution de certains marqueurs du stress oxydatif et à des effets bénéfiques sur la fertilité et le système immunitaire.
Les carences ne sont pas rares chez les chevaux. En effet, certains sols sont naturellement pauvres en sélénium. La vitamine E est produite par les plantes lors de la photosynthèse mais elle est rapidement dégradée lors du stockage sous forme de foin.
Selon une étude récente (J Vet Intern Med 2020, 34:2132-2141), des concentrations sanguines suboptimales en sélénium et en vitamine E ont été observées chez 16.7% et 35.5% des chevaux respectivement, malgré une supplémentation par les propriétaires.
Un suivi régulier est donc recommandé par les auteurs de cette étude afin de contrôler le statut en vitamine E et sélénium des chevaux, même lorsque le propriétaire apporte des compléments alimentaires.

Infectiologie : prélèvement et interprétation
Bactériologie et mycologie
Remarques générales :
Les prélèvements liquides (ex. lavage, épanchement, pus) et solides (ex. biopsies, produits de grattage, etc.) peuvent être placés dans un pot stérile ou un tube sec (avec un fond de saline stérile pour les prélèvements solides). Ils sont maintenus réfrigérés jusqu’à l’envoi sous 24-48h.
Les écouvillons peuvent être laissés à T° ambiante et acheminés au laboratoire sous 3-5 jours. Il est préférable d’utiliser des écouvillons associés à des milieux de transport (type Amies ou Stuart). Ils sont fournis par le laboratoire VETODIAG.
Note : Il est également possible de verser un prélèvement liquide (ex. Lavage respiratoire, épanchement) dans le milieu de transport d’un écouvillon, ou de tremper l’écouvillon dans l’échantillon, afin d’assurer une bonne conservation du prélèvement.
Si l’animal est sous antibiotique(s)/antifongique(s), un arrêt du traitement minimum 48h avant le prélèvement (idéalement 8 jours) est recommandé.
Prélèvement cutané et auriculaire :
La désinfection de la surface cutanée sur le site de prélèvement est déconseillée car elle détruit les germes pathogènes autant que les contaminants (un flushage à la saline stérile peut-être réalisé si la zone semble particulièrement souillée).
– Vésicules : ponction/aspiration du liquide vésiculaire
– Ulcérations : grattage/écouvillon au fond de l’ulcère (en soulevant éventuellement les croûtes et autres débris de surface).
– Pustules : ouverture au scalpel stérile et grattage/écouvillon des parois
– Lésions auriculaires : écouvillonnage profond après avoir enlevé le cérumen superficiel
– Lésions cutanées profondes : il est recommandé de soumettre une biopsie dermique (excision de l’épiderme superficiel source de contamination).
Collections purulentes :
Lorsqu’un abcès est présent, il est préférable, après débridement chirurgical, de prélever un morceau de la paroi de l’abcès ou d’écouvillonner les parois.
Les collections purulentes de grandes cavités peuvent être aspirées (après préparation aseptique du site de ponction).
Prélèvement respiratoire :
Les lavages bronchoalvéolaires sous fibroscopie ou par voie transtrachéale permettent le diagnostic bactériologique ou mycologique des infections pulmonaires en veillant à éviter une contamination par la flore oro-naso-pharyngée.
Prélèvement sinusal :
Seuls les prélèvements effectués par lavage des sinus ou des cornets nasaux, ou par biopsie, peuvent permettre d’isoler le germe pathogène.
L’ écouvillonnage des fosses nasales ne permettent généralement pas d’isoler le germe responsable (et flore contaminante).
Prélèvement intestinal :
Selles (ou écouvillon) conservées à l’obscurité et au frais (+ 4 °C), envoyées au laboratoire sous 24-48h.
Prélèvement oculaire :
Un raclage doux de la conjonctive et de la cornée en évitant les contaminations de la flore cutanée palpébrale permet de recueillir les sécrétions purulentes et d’isoler les germes responsables de conjonctivites et de kératites microbiennes.
Prélèvement urinaire :
Chez les carnivores, les urines doivent si possible être recueillies de façon stérile soit par cystocentèse, soit par cathétérisme.
Par miction, les urines sont recueillies dans un contenant propre, idéalement après un lavage des voies uro-génitales externes de l’animal (eau du robinet sans savon/antiseptique) et une éventuelle coupe ou tonte des poils dépassant des voies externes. Les premiers jets doivent, si possible, être exclus.
Les urines sont conservées immédiatement à 4°C jusqu’à l’envoi (à l’abri de la lumière).
Prélèvement ostéoarticulaire :
Une biopsie osseuse ou une ponction de liquide articulaire (placée dans un tube sec ou dans le milieu de transport d’un écouvillon) permet de réaliser une culture bactérienne. L’écouvillonnage d’un trajet fistuleux peut aussi être réalisé.
Septicémie :
Idéalement, au moins trois prélèvements (flacons d’hémoculture fournis par le laboratoire) sur 48 h, si possible au moment des pics d’hyperthermie, sont réalisés.
Remarques générales :
L’interprétation d’un examen bactériologique ne peut être réalisée que si le prélèvement a été effectué avant l’instauration d’un traitement antibiotique (arrêt 7 jours idéalement avant la date du prélèvement).
L’isolement d’une bactérie à partir d’un prélèvement biologique ne suffit pas toujours à établir un diagnostic de certitude (hormis l’isolement d’un agent pathogène strict comme Streptococcus equi subsp. equi dans un prélèvement des voies respiratoires supérieures).
L’isolement de certaines espèces bactériennes telles que Bacillus spp., des streptocoques béta-hémolytiques, des staphylocoques à coagulase négative doit faire suspecter une contamination lors du prélèvement, surtout lorsqu’elles sont en faible quantité et associées à d’autres espèces.
Quand le prélèvement est effectué à partir d’un site doté d’une flore saprophyte ou endogène, les cultures montrent une population microbienne variée. Il convient alors de s’intéresser aux bactéries qui n’appartiennent pas à cette flore “normale”. Il est parfois très difficile de connaitre le réel pouvoir pathogène d’une bactérie, d’autant plus que la plupart peuvent être considérées à la fois comme des bactéries saprophytes et des agents pathogènes opportunistes. L’examen cytologique se révèle alors indispensable.
Outre la nature des bactéries isolées, l’étude de leur abondance au sein du prélèvement est fondamentale dans l’interprétation des examens bactériologiques (voir les sections concernées plus bas).
L’examen cytologique est très souvent nécessaire pour confirmer un diagnostic de maladie infectieuse, notamment dans les prélèvements de liquides biologiques (lavages respiratoires, utérins, etc.), pour lesquels il n’est pas rare de rencontrer une contamination par une flore endogène.
Lors de demande d’analyse bactériologique à partir de liquides biologiques (prélevés sur tube sec ou en flacon stérile), il est donc important d’associer un tube EDTA pour la cytologie.
Les infections respiratoires
Si une bactérie est retrouvée à une concentration supérieure à 10 000 UFC/ml, sa présence est considérée comme significative. Cependant, au-delà de trois micro-organismes (≥ à 10 000 UFC/ml), le prélèvement doit être considéré comme contaminé.
L’isolement à plus de 10 000 UFC/ml de Pseudomonas spp. ou de Pseudomonas fluorescens (non pathogènes) dans un lavage effectué par voie transendoscopique doit conduire à suspecter une contamination du prélèvement (et à considérer la procédure de décontamination de l’endoscope comme étant inadéquate).
Plusieurs agents sont considérés comme pathogènes dans les liquides respiratoires. La gourme et la rhodococcose constituent les deux maladies bactériennes contagieuses majeures des voies respiratoires équines.
Principales bactéries à l’origine d’infections respiratoires :
– Actinobacillus equuli
– Bordetella bronchiseptica
– Enterobacter spp.
– Escherichia coli
– Klebsiella pneumoniae
– Stenotrophomonas maltophilia
– Pasteurella multocida
– Pseudomonas aeruginosa
– Rhodococcus equi
– Staphylocoques coagulase positive
– Streptococcus pneumoniae
– Streptocoques β-hémolytiques
– Mycoplasmes
– Bactéries anaérobies : Bacteroides spp., Fusobacterium necrophorum
Cas particulier de la Gourme :
Prélèvement recommandé (PCR + bactériologie pour augmenter la sensibilité) : lavage des poches gutturales (portage asymptomatique), écouvillon naso-pharyngé (voire pus, LT).
Bronchopneumonie à Rhodococcus equi :
Le diagnostic définitif repose sur la culture bactériologique et l’amplification du gène VapA par PCR (mise en évidence du plasmide de virulence) à partir du lavage trachéal
Les infections digestives
Chez l’adulte, les salmonelloses et les clostridioses demeurent les causes les plus fréquentes de diarrhée, alors que les poulains sont plus souvent infectés par Lawsonia intracellularis ou R. equi (la forme intestinale de la rhodococcose, souvent à l’origine d’abcès abdominaux).
Pour la recherche de Salmonella spp., il est recommandé de réaliser des coprocultures sur trois prélèvements espacés de 24 heures.
Les fèces doivent être acheminés dans des pots stériles remplis à ras bord (l’absence d’oxygène préserve les bactéries anaérobies).
Principales bactéries à l’origine d’infections digestives :
- Escherichia coli
- Clostridium perfringens,
– C. difficile
– Rhodococcus equi (poulain)
- Salmonella spp.
- Lawsonia intracellularis
- Campylobacter jejuni
– Campylobacter coli
En cas de Péritonite :
- Bactéries anaérobies (Bacteroides spp., Clostridium spp., Fusobacterium spp.)
- Entérobactéries
- Streptocoques β-hémolytiques
En cas d’abcès hépatiques :
- Bactéries anaérobies
- Streptocoques β-hémolytiques
- Leptospires
Les infections génitales
Le prélèvement en vue d’un examen bactériologique est réalisé en premier lieu à partir d’un lavage utérin de grand ou petit volume, ou d’une cytobrosse. Il convient de prévoir un tube EDTA pour l’examen cytologique, nécessaire à l’interprétation du résultat bactériologique.
Pour les liquides utérins, le seuil de 1 000 CFU/ml doit être retenu comme significatif.
Principales bactéries à l’origine d’infections génitales (endomètre, pyomètre, infertilité) :
- Actinobacillus equuli
- Actinomyces pyogenes
- Enterobacter spp.
- Escherichia coli
- Klebsiella spp.
- Pseudomonas aeruginosa
- Staphylocoques coagulase positive
- Streptocoques β-hémolytiques
- Taylorella equigenitalis
- Bactéries anaérobies (Fusobacterium necrophorum, Bacteroides spp., Clostridium spp.).
En cas d’avortement :
Les prélèvements de choix pour un examen bactériologique sont les annexes fœtales, le cordon ombilical, le contenu stomacal et/ou les organes (tropisme particulier de certaines bactéries pour des organes)
- Actinobacillus equuli
- Enterobacter spp.
- Escherichia coli
- Klebsiella spp.
- Pseudomonas aeruginosa
- Salmonella spp.
- Staphylocoques coagulase positive
- Streptocoques β-hémolytiques
Les infections cutanées
La flore saprophyte résidente limite l’intérêt des examens bactériologiques cutanés aux cas de pyodermite, de surinfection de plaies ou de lésions purulentes. Le prélèvement doit être constitué d’un écouvillon en Amies-charbon ou d’une biopsie. Le prélèvement de poils doit être réservé aux recherches fongiques telles que les teignes (dermatophytes). Lors de dermatophilose, la recherche de Dermatophilus se fait à partir de croûtes prélevées chez le cheval. Dans le cas d’un abcès sous-cutané, il est préconisé de gratter l’intérieur de la coque de celui-ci, car le pus est souvent stérile (en raison de sa composition quasi exclusive en polynucléaires neutrophiles). En cas de plaies profondes ou de fistules, il est important de demander une recherche de bactéries anaérobies, en plus d’une bactériologie aérobie.
Parmi les bactéries impliquées dans ces infections, Staphylococcus aureus et Dermatophilus congolensis sont des agents majeurs
Principales bactéries à l’origine d’infections cutanées :
- Dermatophilus congolensis (diagnostic de certitude = examen cytologique)
- Escherichia coli
- Proteus spp.
- Pseudomonas aeruginosa
- Staphylocoques coagulase positive
- Streptocoques β-hémolytiques
- Corynebacterium pseudotuberculosis (lors de lymphangite)
Les infections oculaires
La plupart des infections oculaires (conjonctivites, kératites, ulcères de cornée, etc.) sont d’origine bactérienne primaire ou secondaire (complications d’infections virales, parasitaires ou de traumatisme).
La recherche de bactéries est réalisée à partir de frottis conjonctivaux et cornéens par écouvillonnage, par raclage à la spatule ou à l’aide d’une cytobrosse stérile.
Les arthrites bactériennes
La ponction de liquide synovial est le prélèvement de choix. Il est recommandé d’utiliser des flacons de type « hémoculture » pour le transport du prélèvement, ce qui préserve les bactéries et permet un début de croissance pendant le transport. Dans tous les cas, un résultat négatif ne permet pas d’exclure un processus septique, d’où l’intérêt de réaliser une analyse cytologique en parallèle.
Les infections urinaires
Pour les urines, Le seuil bactériologique de positivité est de 1 000 UFC/ml lors de recueil par cathétérisme urétral, et de 40 000 UFC/ml lors d’une miction spontanée. Ce résultat doit être confronté à l’examen cytologique de l’urine (vérifier la présence d’une pyurie).
Conditions de prélèvement :
– Avec une brosse à dents à poils souples (neuve et dans un emballage unique), brosser énergiquement la zone atteinte (en périphérie) pendant 2-3 minutes jusqu’à remplir la brosse à dents avec les poils de l’animal. Envoyer la brosse à dents dans son sachet.
Ou
– Raclage à l’aide d’un scalpel mousse en périphérie de la zone atteinte et envoyer les poils/squames dans un tube sec, flacon ou sachet.
Ou
– Arracher des groupes de poils en périphérie de la zone atteinte (ex. pince hémostatique) et les envoyer dans un tube sec, flacon ou sachet. Cette dernière technique semble moins efficace.
La lésion à prélever est désinfectée à l’alcool à 70° (éponge inhibée pendant 30 secondes), l’alcool élimine la majorité des contaminants sans nuire aux dermatophytes.
Le prélèvement peut éventuellement être réalisé sous la lumière de Wood pour les teignes à Microsporum canis (mise en évidence que dans environ 50 % de cas).
Interprétation :
Le trichogramme (examen direct des poils, croûtes, squames) permet d’identifier les dermatophytes et les ectoparasites de surface. Cet examen, peu sensible, ne permet pas d’exclure une dermatophytose s’il est négatif.
Une culture fongique (voire une PCR) est alors recommandée : en général, une incubation contrôlée à 27-30 °C permet d’obtenir une réponse dans un délai de moins de deux semaines. L’identification des fongi est principalement réalisée par spectromètre de masse MALDI-TOF au laboratoire VETODIAG.
La biopsie cutanée peut aussi constituer un examen complémentaire utile pour orienter un diagnostic différentiel de dermatophytie. Cette biopsie est réalisée à l’aide d’un trépan à biopsie (type biopsy punch de diamètre 6 mm) au centre de la lésion.
Coprologie
Conditions de prélèvement :
Selles conservées à l’obscurité et au frais (+ 4 °C), envoyées au laboratoire sous 48-72h.
Interprétation :
Les facteurs de virulence les plus significatifs associés aux diarrhées à Clostridium difficile sont l’entérotoxine A et la cytotoxine B.
Chez le chien/chat, C. difficile peut être détecté dans les selles d’animaux sains (jeunes ou adultes) comme chez ceux souffrant de diarrhée. Une corrélation significative entre la présence de C. difficile et la présence de diarrhée n’a pas pu être prouvée, toutefois, la production de toxines est davantage détectée chez les animaux malades. Il existe un risque zoonotique (et de transmission de l’homme à l’animal).
Chez le cheval, les infections à C. difficile peuvent être associées à C. perfringens, touchent plus particulièrement les poulains ou les chevaux ayant reçu une antibiothérapie massive, et se manifestent par des signes de coliques (sans ou avant l’apparition d’une diarrhée).
Clostridium perfringens fait partie des bactéries digestives commensales. Des facteurs endogènes (comorbidités, autres agents infectieux, antibiothérapies modifiant la flore digestive, etc.) et des facteurs exogènes (stress, changements alimentaires, etc.) peuvent conduire à une augmentation de la pathogénicité de C. perfringens avec production de toxines. L’entérotoxine de Clostridium est davantage détectée chez les animaux en diarrhée comparativement aux animaux sains.
Conditions de prélèvement :
Selles (ou écouvillon) conservées à l’obscurité et au frais (+ 4 °C), envoyées au laboratoire sous 24-48h.
Interprétation :
Les entérites primitives bactériennes sont rares chez les carnivores domestiques : Salmonella spp., Campylobacter jejuni, Clostridium difficile, Clostridium perfringens (et éventuellement Yersinia spp. et Shigella spp.) sont rapportés.
L’implication supposée de Clostridium spp. repose principalement sur la détection des toxines produites par ces bactéries (tests immunologiques réalisés au laboratoire).
Toutes ces bactéries étant également présentes chez des animaux sains (flore normale ou portage subclinique), la mise en place d’une antibiothérapie sera plutôt réservée aux entéropathies avec atteinte systémique (considérer le rapport bénéfice/risque en raison des résistances bactériennes et dérives de flore possibles).
Les situations où l’antibiothérapie est indiquée se limitent à :
1. Entérite aigue grave avec rupture de la barrière épithéliale et risque de bactériémie
2. Suspicion d’entérite primitive bactérienne (rare)
3. Entéropathie chronique répondant au métronidazole (entité non reconnue chez le chat)
4. Colite histiocytaire (jeunes boxers et bouledogues français) : antibiothérapie après confirmation histopathologique sur biopsies et antibiogramme du E. coli pariétal
Escherichia coli (avec les autres entérobactéries) et Enterococcus font partie de la flore bactérienne commensale (digestive ou environnementale) chez le chien et le chat. Une antibiothérapie sur ces germes n’est donc pas recommandée et pourrait de surcroît engendrer des résistances bactériennes ou une dérive de flore délétère.
Conditions de prélèvement :
Selles (ou écouvillon) conservées à l’obscurité et au frais (+ 4 °C), envoyées au laboratoire sous 24-48h.
Interprétation :
Les causes de diarrhées peuvent être multiples, infectieuses ou non. Chez le cheval adulte, outre les causes parasitaires, les causes infectieuses les plus fréquentes sont : Salmonella spp. (diagnostic par culture et PCR), Clostridium perfringens et Clostridium difficile (détection des toxines produites par ces bactéries par des tests immunologiques réalisés au laboratoire – nous contacter si besoin), Campylobacter spp (diagnostic par culture), coronavirus équin (diagnostic par PCR). Yersinia spp. a été également été rapporté.
Chez le poulain, en plus de ces précédents agents, d’autres peuvent être impliqués : rotavirus (diagnostic par PCR), Cryptosporidium (test immunologique), Lawsonia intracellularis (poulains sevrés et yearlings, diagnostic par PCR), Rhodococcus equi (diagnostic par PCR ou culture).
La plupart des bactéries citées étant également présentes chez des animaux sains (flore normale ou portage subclinique), la mise en place d’une antibiothérapie sera plutôt réservée aux entéropathies avec atteinte systémique (considérer le rapport bénéfice/risque en raison des résistances bactériennes et dérives de flore possibles).
Escherichia coli (avec les autres entérobactéries) et Enterococcus font partie de la flore bactérienne commensale (digestive ou environnementale). Une antibiothérapie sur ces germes n’est donc pas recommandée et pourrait de surcroît engendrer des résistances bactériennes ou une dérive de flore délétère.
Conditions de prélèvement :
Quantité minimale de 2 à 5 g (10 g pour la technique de Baermann visant à rechercher les larves de nématodes respiratoires) de selles fraîches et non souillées, récoltées idéalement en intra-rectal ou immédiatement après la défécation, et si possible 3 prélèvements sur 3 jours consécutifs. Les selles peuvent être conservées plusieurs jours dans un pot propre, à l’obscurité et au frais (+ 4 °C).
Interprétation :
Un résultat négatif ne permet pas d’exclure une parasitose (ex. excrétion intermittente, parasite peu prolifique ou période pré-patente longue).
Face à un résultat positif, un traitement est à mettre en place et ce quel que soit le nombre d’éléments parasitaires observés car il n’existe aucun lien entre la charge parasitaire fécale et l’intensité de la maladie. Lors de charge importante, on peut bien sûr conclure à un parasitisme élevé, mais l’inverse n’est pas forcément vrai.
Le cas de la coccidiose peut faire exception. En effet, la mise en évidence d’ookystes de coccidies chez l’adulte non immunodéprimé n’étant pas anormal, elle ne conduira pas systématiquement à une thérapie.
La sensibilité de la coproscopie n’est pas suffisante pour la recherche de Giardia sp., Cryptosporidium sp. et Tritrichomonas sp. (chat), un test PCR ou antigénique est alors recommandé pour compléter l’examen microscopique.
Revue des principaux parasites identifiés par coproscopie chez le chien et le chat
Source : PratiqueVet (2011) 46 : 33-37

Conditions de prélèvement :
Prélever idéalement plusieurs crottins frais (pour un total d’environ 500g), à conserver au réfrigérateur en anaérobie jusqu’à l’envoi.
Interprétation :
Pour les chevaux de plus de 3 ans, il est conseillé de réaliser 3 coproscopies sur une année (entre avril et novembre) pour connaitre leur statut de faible/fort excréteur (en particulier pour les Strongles).
L’excrétion intermittente des oeufs et la prédominance de formes larvaires peuvent entraîner des résultats faussement négatifs.
PCR
Prélèvement :
Les prélèvements doivent être riches en cellules et le sang non centrifugé, de nombreux pathogènes étant intra-cellulaires. Les supports sont des tubes EDTA (pour le sang impérativement et éventuellement pour le liquide céphalorachidien, l’humeur aqueuse, l’urine ou les épanchements) ou des tubes secs (utilisables pour tous les prélèvements à l’exception du sang). Les tubes héparinés sont à proscrire dans tous les cas.
La fixation des tissus (formol, Bouin) altère les acides nucléiques ; les tissus frais ou congelés sont les prélèvements de choix.
Les écouvillons (rectaux, oropharyngés…) sont des écouvillons secs en coton et sans milieu de transport.
Les prélèvements oculaires peuvent être réalisés après instillation de fluorescéine.
Les prélèvements sont expédiés à température ambiante.
Il est préférable de prélever avant la mise sous traitement antibiotique, antiviral ou antiparasitaire et d’attendre au minimum 15 jours après l’arrêt du traitement pour le suivi post-thérapeutique (Ehrlichiose, hémobartonellose,…).
Interprétation :
Résultats négatifs et seuil de détection
Un résultat négatif signifie que l’agent infectieux recherché n’est pas présent ou en quantité inférieure au seuil de détection du test.
Résultats quantitatifs
Les méthodes quantitatives apportent souvent une information pertinente pour interpréter un résultat positif (Est-il significatif dans un contexte de suspicion clinique ? L’animal présente-t-il un danger pour un congénère ?). Elles sont particulièrement intéressantes si le portage asymptomatique est fréquent (ex. virus digestifs en collectivité). Par exemple, en collectivité, la plupart des chiots sont porteurs de parvovirus. Un résultat positif en PCR sur un écouvillon rectal ou même sur sang ne permet donc pas de conclure à une parvovirose. Seule la présence d’une charge virale importante est significative dans un contexte clinique. Le plus souvent, les charges virales sont très largement supérieures lors d’infection clinique aiguë (ex. parvovirus), mais ce n’est pas le cas pour les formes chroniques.
Détection possible d’agents infectieux non viables (ou ne pouvant être mis en culture)
Les traitements spécifiques et le système immunitaire (et certains facteurs pré-analytiques comme le délai d’analyse ou les conditions de conservation du prélèvement) participent à la destruction et à l’élimination des agents infectieux. La détection des acides nucléiques provenant d’organismes non viables (dont la culture serait difficile voire impossible) est possible mais reste limité dans le temps.
Résultat positif et interférence avec la vaccination
La PCR peut détecter une souche vaccinale dans les jours/semaines suivant l’injection d’un vaccin vivant (ex. parvovirus; charge virale généralement faible). En revanche, la présence d’anticorps d’origine maternelle, vaccinale ou post-infectieuse n’interfère pas avec le diagnostic PCR. Il est par exemple possible de dépister une infection par le FIV chez un chat né de mère séropositive.
PCR ou sérologie ?
En pratique, dans un contexte de diagnostic, la PCR sera généralement préférée dans les phases aiguës de l’infection, ou lorsque le contexte épidémiologique rend difficile l’interprétation d’une séropositivité (contexte d’enzootie, vaccination antérieure,…). La PCR offre aussi la possibilité d’identifier des porteurs asymptomatiques, ce qui peut être utilisé pour la prévention de transmission d’agents infectieux dans un contexte d’élevage.
La sérologie pourra être intéressante en phase plus chronique, et notamment si un traitement ayant pu éliminer l’agent pathogène a été mis en place. La sérologie sera également préférée si un échantillon contenant l’agent pathogène ne peut pas être obtenu. Dans un contexte d’épidémiosurveillance et de prévention, l’utilisation de tests sérologiques permet la réalisation de grandes études de séroprévalence.
Conditions de prélèvement :
Ecouvillon oro-nasopharyngé, LT/LBA (tube sec)
Conservation et stabilité (si envoi différé) : 48h à 72h
Interprétation :
Le virus de la grippe canine (CPiV) et l’adénovirus canin de type 2 (CAV2) sont les agents primaires de la toux de chenil et une surinfection bactérienne à Bordetella bronchiseptica demeure très fréquente.
L’Hespèsvirus canin est un agent secondaire, tout comme Mycoplasma sp. (ou encore Pasteurella et Pseudomonas sp.). Des coronavirus canins à tropisme respiratoire (CRCoV) ont récemment été envisagés comme cofacteurs de la maladie en Europe.
Conditions de prélèvement :
Sang total EDTA, LCR, synovie
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Un résultat PCR négatif dans le sang ne permet pas d’exclure une borréliose (bactériémie faible et fugace).
Contrairement à l’homme, 95 % des chiens exposés à B. burgdorferi restent asymptomatiques. Les signes cliniques aigus sont en général peu spécifiques (abattement, fièvre, anorexie et adénomégalie). Un chancre d’inoculation est rarement observé chez le Chien. Des formes d’atteinte rénale, articulaire ou nerveuse sont décrites. Le diagnostic de la borréliose repose classiquement sur cinq critères : la présence de signes cliniques compatibles, la présence de l’agent vectoriel dans l’environnement (Ixodes ricinus en Europe), un test sérologique positif, l’exclusion des autres hypothèses diagnostiques, et une réponse thérapeutique appropriée.
Conditions de prélèvement :
Lors de forme classique : écouvillonnage (ou cytobrosse) des muqueuses nasales/conjonctivales et cellules oro-pharyngées (amygdales lors de recherche de portage chronique asymptomatique), LBA.
Lors de forme virulente systémique : recherche sur sang, tissus ou organes atteints (peau, pancréas, rate, poumon, foie…).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré (sang, tissus ou organes)
Interprétation :
Il existe une forte prévalence du calicivirus dans l’espèce féline et une forte contagiosité. La variabilité génomique et antigénique (virus à ARN) est forte également : nombreuses souches circulantes de pouvoir pathogène variable, spectre de couverture vaccinale faillible, réinfections et portage oropharyngé persistant possibles.
L’interprétation de certains résultats positifs est délicate. Le lien entre les signes cliniques observés et la mise en évidence du calicivirus peut être difficile à établir, notamment en raison de la possibilité de portage oropharyngé chronique asymptomatique (surtout chez les chats hébergés en collectivité). Après infection, la plupart des chats éliminent le virus en moins de 30 jours, mais certains excrètent le virus pendant plusieurs années.
Conditions de prélèvement :
Ecouvillon/cytobrosse conjonctival (cul de sac) et nasal, LCS, sang EDTA (total ou plasma), urines, organes (poumon, cerveau)
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
La forme aiguë de la maladie de Carré peut s’envisager chez tout chiot entre 3 et 6 mois (non ou mal vacciné) présentant des troubles multiorganiques consécutifs à la dissémination du virus dans tous les épithéliums (signes respiratoires en 8 à 10 jours puis digestifs, oculaires, cutanés et nerveux après 12 jours). Dans 25 à 75 % des cas, on rencontre une forme subclinique avec des signes frustes et transitoires puis une guérison. Le virus demeure néanmoins dans le système nerveux central et peut induire la forme chronique nerveuse que l’on retrouve chez l’adulte.
Pour la forme juvénile classique, le prélèvement au niveau du cul de sac conjonctival semble montrer une meilleure sensibilité (proche de 100%) que l’écouvillon nasal, le LCS, le sang total/plasma, ou les urines.
Pour la forme nerveuse de l’adulte, le virus peut être recherché dans le LCS et les urines.
Conditions de prélèvement :
Ecouvillon conjonctival
Conservation et stabilité (si envoi différé) : 48h à 72h
Interprétation :
Chlamydophila felis est probablement le premier agent de conjonctivite bactérienne chez le chat.
La conjonctivite est le plus souvent unilatérale au départ pour devenir bilatérale en 5 à 7 jours. Un chémosis est presque constant. Une atteinte respiratoire sans atteinte conjonctivale n’est pas en faveur d’une atteinte par C. felis. Il n’existe pas d’atteinte associée de la cornée. Les symptômes conjonctivaux cessent en général au bout de deux mois (infection chronique possible).
La détection de la bactérie peut s’effectuée par cytologie d’un frottis conjonctival dans les premiers jours après l’infection (sensibilité < 50%) ou par PCR.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Ce type d’infection est surtout documenté chez les jeunes chiots de 2 à 3 mois, en élevage.
Les symptômes digestifs sont généralement modérés. Toutefois, il existe des situations où ces infections peuvent se révéler fatales. Pour les infections par le CCoV, il est décrit depuis 2005 l’existence de souches appelées pantropiques. Dans ce cas, l’infection par le CCoV ne se limite plus au tractus intestinal mais diffuse dans différents organes jusqu’aux poumons.
Une infection conjointe par le parvovirus est fréquente.
Le diagnostic se fait par RT-qPCR sur écouvillon rectal.
Conditions de prélèvement :
Sang total, épanchement, LCR, humeur aqueuse (tube EDTA)
Biopsies non formolées placées dans un tube sec ou dans un pot (rein, foie, poumon, NL mésentérique, etc.)
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
Si un épanchement est présent, une PCR sur le liquide peut être réalisée (sensibilité de 80% et spécificité de 90-100%). En pratique, une charge virale forte dans l’épanchement, associée à l’ensemble des éléments cliniques et biologiques, permet de conclure à une PIF.
Avec une présentation neurologique ou oculaire, une PCR peut aussi être réalisée sur le LCR ou l’humeur aqueuse (sensibilité moyenne et spécificité > 95%). La PCR dans le sang, la rate, les noeuds lymphatiques et la moelle osseuse peut être positive chez des chats sains (charges souvent faibles dans ce cas).
En cas de doute sur l’interprétation d’un résultat positif, il peut être intéressant de réaliser en parallèle une PCR quantitative sur écouvillon rectal. Les animaux malades n’excrétant que peu ou pas de virus, une charge rectale faible ou un résultat négatif associé à la présence de virus dans un épanchement, du LCS ou même du sang constitue un critère diagnostique supplémentaire. Inversement, une charge rectale élevée doit conduire à reconsidérer l’hypothèse de PIF.
Le diagnostic de certitude reste histopathologique (immunohistochimie).
Dépistage de la PIF en élevage :
Plus de 50% des chats en élevage seraient porteurs du coronavirus ; la contamination se fait par voie orofécale, le virus pouvant survivre jusqu’à 7 semaines dans les selles. Suite à une mutation du virus, 2-5% des chats développent une PIF, mais la transmission directe du virus muté entre chats n’a jamais été démontrée.
Dans un élevage atteint, des mesures prophylactiques seront mises en place pour limiter la contagion car 70-80% des chats sains de l’élevage continuent à excréter du virus non muté de manière intermittente ou permanente. Pour repérer les chats excréteurs, une PCR sur selles peut être réalisée, accompagnée idéalement d’une sérologie sur l’ensemble des adultes en contact avec les chatons (au moins la mère des chatons concernés).
Si une mère est excrétrice, il est conseillé de sevrer les chatons dès l’âge de 3-4 semaines ou de les faire adopter par une reproductrice allaitante non excrétrice.
Conditions de prélèvement :
Sang total EDTA, NL, MO, rate, LCR
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PCR est la technique de choix pour le diagnostic de la phase aiguë de la maladie. L’examen est réalisé à partir du sang périphérique prélevé sur EDTA.
De l’ADN de ces agents pathogènes peut aussi être retrouvé sur des prélèvements de rate ou de moelle osseuse chez le Chien lors de la phase chronique, mais aussi sur des animaux ayant guéri de la maladie (porteurs sains).
Tout traitement anti-infectieux (tétracycline, quinolones, imidocarbe) peut entraîner une négativation plus ou moins rapide et durable de la PCR : un résultat négatif devra donc être interprété avec précaution sur un animal ayant reçu ce type de traitement.
La PCR est plus sensible que l’examen direct du frottis sanguin. Un résultat positif peut être obtenu 6 à 8 jours avant et 3 jours après l’apparition des morulas dans le sang (cas d’Anaplasma phagocytophilum).
Conditions de prélèvement :
Sang total EDTA, LCR, MO, écouvillon oro-nasopharyngé, organes.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La RT-PCR peut être réalisée en première intention ou en seconde intention pour confirmer un résultat positif obtenu par un test antigénique (ceux-ci ayant une valeur prédictive positive peu élevée en raison de la prévalence faible de la maladie dans la population générale).
Compte tenu de la possibilité d’infection régressive avec virémie transitoire (élimination ou possible portage latent et réactivation ultérieure du virus), un contrôle (PCR ou test antigénique) est recommandé quelques mois après un premier test positif.
Si une exposition récente ne peut être exclue, un résultat négatif doit être confirmé par un test de contrôle minimum 30 jours après le test initial.
Conditions de prélèvement :
Sang total EDTA, LCR, MO, écouvillon oro-nasopharyngé, organes.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La RT-PCR peut être réalisée en première intention ou à la suite d’un test sérologique positif. En effet, si le test sérologique est positif, chez un animal asymptomatique ou qui a peu de risques d’avoir été exposé, il est recommandé de le confirmer ultérieurement par la réalisation d’une PCR ou d’un second test sérologique (technique différente si possible). Il existe des faux-négatifs en PCR, liés à la variabilité de la séquence virale recherchée (virus ARN) ou à une faible charge circulante.
Chez un chaton, compte tenu de la présence d’anticorps maternels, des faux-positifs aux tests sérologiques sont possibles pendant les 4 voire les 6 premiers mois. La PCR peut alors être utilisée pour préciser le statut de l’animal.
En cas de suspicion d’infection récente, la PCR peut être privilégiée (le délai d’apparition des anticorps pouvant être > 60 jours).
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
La contamination se fait par voie orale à partir de kystes de Giardia présents dans l’environnement, sur le pelage de l’animal, ou des aliments et eau souillés par des matières fécales contaminées. Ces kystes peuvent survivre plusieurs semaines dans l’environnement et sont directement infectants. Après ingestion, le kyste libère deux trophozoïtes qui adhèrent aux entérocytes, à l’origine de signes cliniques. La période prépatente, de l’ingestion de kystes à l’élimination de nouveaux kystes dans les fèces, est de 5 à 7 jours, avec des animaux pouvant excréter des kystes pendant plusieurs semaines à plusieurs mois en l’absence de traitement.
Pour la recherche du parasite, des selles sont prélevées sur 2 à 3 jours afin d’augmenter la sensibilité du test. Le risque de faux négatifs ne doit pas être négligé du fait de l’excrétion intermittente.
Chez les animaux asymptomatiques ayant un test positif pour Giardia, un traitement n’est généralement pas conseillé, tout en n’excluant pas le risque zoonotique qui devrait être discuté avec le propriétaire. Seuls les animaux diagnostiqués positifs pour Giardia et présentant des troubles cliniques compatibles avec une giardiose recevront un traitement.
Pour le suivi du traitement, la coproscopie est à privilégier, car les autres tests peuvent donner des résultats positifs quelques jours (PCR) à plusieurs semaines (tests antigéniques) après l’élimination du parasite.
Conditions de prélèvement :
Selon la présentation clinique : écouvillon (ou cytobrosse) naso-oro-nasopharyngé, kérato-conjonctival, LBA, génital (vaginal/prépucial ou sperme dans un tube sec), organes (rein, rate, foie, poumon non fixés en cas de mortalité néonatale).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Ce virus présente un tropisme respiratoire, génital et nerveux.
Le virus peut être transmis par voie oronasale, vénérienne ou transplacentaire.
Chez le chien adulte, la faible réplication du virus dans l’organisme rend les signes cliniques le plus souvent très discrets (atteinte respiratoire haute légère ou absente, inflammation des muqueuses génitales, avec ou sans vésicules, possible mais peu fréquente). Le virus entre ensuite dans une phase de latence où le génome viral s’intègre dans le noyau des cellules à longue durée de vie (neurones notamment). Tout chien contaminé doit donc être considéré comme infecté à vie. Une réactivation du virus est possible en cas de stress ou d’immunodépression. Chez la chienne gravide, une infection ou une réactivation est suivie d’une atteinte des annexes fœtales.
Chez le chiot de moins de trois semaines, une réplication rapide dans les tissus lymphoïdes est observée avec une forme souvent fatale de la maladie (signes digestifs, respiratoires voire nerveux). La seule protection efficace repose sur l’absorption des anticorps colostraux, qui diminue fortement l’expression des symptômes et la mortalité des chiots.
Les signes d’appel dans un élevage (où la séroprévalence y est élevée +/- 60-80%) sont des troubles de la reproduction, une mortalité importante des chiots de moins de trois semaines.
Un résultat positif en PCR indique la présence du virus dans l’organisme. Celle-ci ne préjuge pas de l’activité virale, sauf sur des chiots morts.
Conditions de prélèvement :
Ecouvillonnage (ou cytobrosse) des cellules oro-pharyngées (amygdales lors de recherche de portage chronique asymptomatique), des muqueuses nasales/conjonctivales (cornée en cas de kératite) et LBA.
Lors d’avortements ou de troubles de la reproduction : cellules vaginales et/ou placentaires, cellules prépuciales et/ou sperme, organes des fœtus.
Conservation et stabilité (si envoi différé) : 48h à 72h – réfrigéré
Interprétation :
Il existe une forte prévalence et une forte contagiosité de l’herpesvirus dans l’espèce féline, avec une fréquence élevée de forme respiratoire et/ou oculaire aiguë, alors que les formes cliniques aiguës atypiques ou chroniques sont plus rares (pneumonie, dermatite, ulcères cutanés et/ou buccaux, atteinte nerveuse, rhinite chronique, etc.).
L’interprétation d’un résultat positif est délicate en raison de la possibilité de portage latent (surtout chez les chats hébergés en collectivité) : les phases de réactivation virales peuvent être associées à une excrétion asymptomatique du virus sans lien avec les manifestations cliniques observées. Inversement, l’obtention d’un résultat négatif est fréquente et ne permet pas de conclure que le virus n’est pas responsable dans certaines formes chroniques (les ganglions nerveux sont le principal site de latence).
Conditions de prélèvement :
Noeud lymphatique, moelle osseuse, peau/conjonctive (biopsies non formolées, cytoponctions, ou raclages cutanés déposés dans un tube sec ou EDTA)
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PCR possède une très bonne sensibilité et une spécificité de 100 %. Cependant, la sensibilité de cet examen dépend du tissu testé (par ordre décroissant : nœud lymphatique ou moelle osseuse, peau, conjonctive, sang, ce dernier présentant une sensibilité proche de 0). Une PCR positive n’est toutefois pas synonyme de maladie et le résultat doit toujours être interprété dans le contexte clinique.
Conditions de prélèvement :
Sang total EDTA, urine (EDTA, tube sec ou flacon), organes (foie, reins, rate des avortons)
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
La PCR est un bon moyen d’établir un diagnostic précoce lorsqu’elle est pratiquée sur du sang (sur EDTA) ou de l’urine, mais doit être réalisée dans les 10 jours suivant le début de l’infection car elle peut se négativer rapidement. La recherche sur un mélange sang et urine est préférable. Un pool d’urines prélevées à différents temps peut augmenter les chances de détection.
Seul un résultat positif peut être interprété avec certitude. La PCR identifie uniquement l’espèce pathogène Leptospira interrogans et non le sérovar en cause.
De nombreux faux négatifs existent, aussi bien dans le sang que dans l’urine, en raison de l’intermittence de la leptospirémie et de la leptospirurie. Une recherche sérologiques des IgM (immunochromatographie), les premières semaines post-infection, ou des IgG (MAT, ELISA), à partir de 3-4 semaines post-infection (2 sérologies à 2 semaines d’intervalle idéalement), peut être intéressante en cas de PCR négative.
Conditions de prélèvement :
Sang total EDTA, moelle osseuse
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Mycoplasma haemofelis est le plus pathogène des hémoplasmes félins et peut être à l’origine d’une anémie hémolytique (M. haemominutum et M. turicensis sont les 2 autres espèces rapportées chez le chat mais qui n’induisent pas d’anémie sauf en cas de coinfection par les rétrovirus félins).
M. haemofelis est observé au frottis sanguin dans moins de 50 % des cas lors des phases aiguës de la maladie. La PCR est donc le test de choix : beaucoup plus sensible, elle permet une reconnaissance différentielle des espèces de mycoplasme et l’évaluation de la charge parasitaire.
La PCR doit être envisagée avant tout traitement antibiotique. Elle peut rester positive après traitement (faible charge dans ce cas). Une recherche conjointe du FeLV et FIV est recommandée (pronostic et décision thérapeutique).
Conditions de prélèvement :
Avec un écouvillon sec ou une cytobrosse : cellules conjonctivales, cellules cornéennes en cas de kératite, cellules naso-oro-pharyngées (amygdales pour détecter un portage asymptomatique chronique), LBA.
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
La PCR est indiquée chez les chats présentant des signes cliniques de conjonctivite, kératite ulcéreuse, rhinosinusite, syndrome coryza, et pneumonie.
Pour une interprétation du résultat dans un contexte clinique, il faut tenir compte d’un taux de portage qui peut atteindre 20% dans des prélèvements oro-pharyngés (amygdales) en collectivité chez les animaux asymptomatiques.
Conditions de prélèvement :
LCS, encéphale (post-mortem), biopsie musculaire non fixée
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
La néosporose s’envisage chez le jeune chien (très souvent avant 10 mois) présentant des signes cliniques nerveux avec parésie des membres postérieurs évoluant vers une paralysie évolutive, ataxie, myalgies, signes de méninogencéphalomyélite.
La détection de Neospora caninum dans le LCS, les muscles ou l’encéphale confirme la maladie lors de troubles neuromusculaires. La quantité de parasites dans le LCS est souvent faible (contrairement aux tissus notamment les muscles).
Conditions de prélèvement :
– Exploration de troubles de la reproduction : Organes fœtaux ou du chiot décédé sur tube sec (poumon, foie, rein, rate), placenta sur tube sec, écouvillon vaginal de la femelle.
– Détermination de statut des animaux asymptomatiques : prélèvement oro-pharyngé, conjonctival, vaginal ou préputial (écouvillons), sperme (tube sec).
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
Dans un contexte de troubles de la gestation, d’avortement ou de mortinatalité, la présence de virus est compatible avec des troubles de la reproduction à parvovirus type 1 (virus minute). Chez un chien adulte asymptomatique, la présence du virus témoigne d’une excrétion. L’animal est probablement contagieux.
A noter que les charges virales sont souvent faibles y compris chez les animaux symptomatiques et que le virus minute peut ne pas être le seul agent infectieux responsable des troubles observés.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
En général, les chiens atteints d’une gastro-entérite secondaire au parvovirus présentent une charge virale forte dans les selles. Une leucopénie, une lymphopénie et une hypoalbuminémie sont des facteurs pronostiques péjoratifs. Une augmentation de la protéine C-réactive (CRP) est associée à la mortalité. Le taux de mortalité est également plus élevé chez certaines races comme le Dobermann, le Rottweiler, le Pit-bull et le Berger allemand.
Les co-infections sont nombreuses et peuvent être recherchées : ex. Coronavirus, Salmonella sp., Escherichia Coli, Campylobacter sp., Clostridium perfringens, Clostridium difficile, Toxocara sp., Giardia sp., Isospora sp.
Le chien peut être porteur asymptomatique, notamment en collectivité. Une interférence avec la vaccination (vaccin vivant atténué) est possible : le virus peut être détecté dans les selles (charge souvent faible) durant quelques semaines/mois après la vaccination.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
La panleucopénie ou parvovirose féline est une virose fréquente et très contagieuse dont les manifestations sont dominées par des troubles digestifs associés à une leucopénie marquée, chez les chatons plus de 4 semaines. Elle est mortelle dans environ la moitié des cas, ce qui justifie un diagnostic rapide par PCR ou tests antigéniques.
Lors de contamination in utero durant le dernier tiers de la gestation ou dans les deux semaines suivant la naissance, le virus peut provoquer une atrophie cérébelleuse à l’origine d’ataxie chez les chatons. La contamination in utero pendant les deux premiers tiers de la gestation est à l’origine d’avortement.
L’administration récente (< 2-3 semaines) d’un vaccin atténué peut induire une réaction faussement positive ; il faut dans ce cas préférer la PCR quantitative qui permet d’évaluer la charge virale fécale généralement plus élevée lors d’infection.
Conditions de prélèvement :
Sang total EDTA, moelle osseuse
Conservation et stabilité (si envoi différé) : 48 à 72h – réfrigéré
Interprétation :
Babesia canis est l’agent étiologique principal des babésioses canines en France et en Europe.
Babesia vogeli présente dans les pays du pourtour méditerranéen est considérée comme moins pathogène. Si l’anémie hémolytique est décrite, les complications sont plus rares.
De rares cas d’infection à Babesia gibsoni ont été rapportés en Europe, responsables de formes cliniques souvent plus graves et/ou de rechutes, et une mauvaise réponse aux traitements piroplasmicides classiques.
Sur un frottis, la non-observation des piroplasmes ne permet pas de conclure à l’absence d’infection (défaut de sensibilité). La PCR sur sang total est alors recommandée, notamment en cas de suspicion d’infection par une petite forme de Babesia (plus difficile à observer au frottis sanguin), d’échecs thérapeutiques ou d’atteintes graves. Un deuxième épisode d’hémolyse une semaine à 10 jours après un diagnostic attesté de piroplasmose doit conduire à envisager une complication d’anémie immunitaire secondaire et à la réalisation d’un test de Coombs direct (en plus de l’examen du frottis sanguin).

1. La piroplasmose
a. Etiologie et épidémiologie
La piroplasmose est due à des protozoaires, parasites des globules rouges, essentiellement chez le cheval Theileria equi et Babesia caballi. A noter que d’autres espèces de piroplasmes ont été identifiées chez des chevaux. Leur transmission se fait par morsure de tiques, une transmission transplacentaire est également possible avec Theileria et Babesia (qui peuvent être à l’origine d’avortement/mortinatalité). Un portage chronique est décrit après infection : symptomatique (pour Theileria) ou asymptomatique (pour Theileria / Babesia). C’est une maladie endémique dans de nombreux pays, ce qui pose des problèmes d’exportation vers les pays indemnes.
b. Signes cliniques
La durée d’incubation varie de 10 à 19 jours pour Theileria (qui infecte d’abord les cellules mononucléées puis les globules rouges) et de 7 à 30 jours pour Babesia (qui n’infecte que les globules rouges). La tique n’est donc plus présente lorsqu’apparaissent les signes cliniques. Ceux-ci sont non spécifiques et très variables d’un cas à l’autre. La forme aiguë classique se traduit par une forte hyperthermie (supérieure à 40°C), une léthargie, de l’anorexie, des œdèmes des membres. Les muqueuses peuvent apparaître pâles, ictériques ou congestives, parfois avec des pétéchies. Une pigmenturie peut être observée (urine jaune à rouge-brun). Des cas d’uvéite bilatérale (avec hyphema) sont rapportés.
La forme chronique se traduit par un amaigrissement, de l’abattement, de la contre-performance, parfois une splénomégalie ou des œdèmes. Une forme de myopathie à médiation immune a également été rapportée (avec atrophie et dégénérescence musculaire).
c. Examens complémentaires
– Analyses hémato-biochimiques
Les modifications sont variables et non spécifiques. Sur une forme aigüe, la numération formule sanguine peut révéler une anémie et une thrombocytopénie. Lors de forme chronique, les changements sont inconstants : éventuellement anémie, neutropénie puis monocytose. Les modifications biochimiques rapportées sont : augmentation de la bilirubine totale, parfois augmentation du fibrinogène, diminution de l’albuminémie, du phosphore et du fer. Les enzymes hépatiques (PAL-ASAT-GGT) et la créatine kinase peuvent parfois augmenter.
– Frottis sanguin
Peu sensible, il permet néanmoins de poser le diagnostic si des parasites sont observés. Il est à réaliser idéalement sur sang périphérique pendant un épisode fébrile.
– Sérologie
Différents tests sérologiques existent (fixation du complément, immunofluorescence indirecte, test ELISA), dont les performances sont variables. L’ELISA de compétition est considéré comme le test le plus sensible pour détecter des porteurs chroniques. Concernant la cinétique, les anticorps apparaissent en 7 à 21 jours (variable en fonction de la technique utilisée), un pic est observé entre 1 et 3 mois, puis ils diminuent en 3 à 6 mois et peuvent persister à niveau faible si l’animal est porteur. La réalisation de deux prises de sang à environ 15 jours d’intervalle peut donc être intéressante pour confirmer une infection récente. Après traitement, on observe une diminution du taux d’anticorps avec séronégativation possible au bout de plusieurs mois chez certains chevaux pour Babesia et une élimination possible du parasite. Pour Theileria, une guérison clinique est possible mais l’animal peut rester porteur et sérologiquement positif.
– PCR (Polymerase Chain Reaction)
Technique très sensible et spécifique, la PCR permet de mettre en évidence l’acide nucléique de l’agent pathogène dans l’échantillon. Néanmoins, se pose la question de la détection des cas chroniques, l’interprétation des PCR négatives après traitement alors que la sérologie reste positive jusqu’à 24 mois n’est aujourd’hui pas élucidée. Sur des cas aigus pour lesquels la clinique et la réponse au traitement sont compatibles avec une piroplasmose, mais la PCR revient négative, il faut garder à l’esprit que la parasitémie peut être inconstante (idéalement le fait de coupler PCR et sérologies est alors intéressant) et que d’autres agents infectieux peuvent être impliqués.
d. Traitement
L’imidocarbe dipropionate (Carbesia ND) constitue le traitement de choix. La posologie est variable en fonction de l’agent et de l’objectif souhaité. Pour un traitement symptomatique, le protocole recommandé est le suivant : Babesia 2 mg/kg et Theileria 2-4 mg/kg 2 à 3 fois à 24-72h d’intervalle. Pour une clairance (en vue d’exportation vers un pays indemne) : Babesia 2 mg/kg 2 fois à 24h d’intervalle et Theileria 4 mg/kg 4 fois à 24-72h d’intervalle. De par son activité anti-cholinestérase, les effets secondaires sont fréquents et non anodins : coliques, sudation, diarrhée. Chez l’âne ou les mules, plus sensibles, il est recommandé de ne pas dépasser 2mg/kg. A noter que l’oxytetracycline 6 mg/kg IV pendant 7 jours serait actif contre Theileria (pas Babesia). Des résistances à l’imidocarbe in vivo sur certaines souches de Theileria ont été décrites ainsi qu’une baisse de sensibilité après traitements répétés in vitro.
e. Diagnostic différentiel
Les signes classiquement décrits pour la piroplasmose (fièvre, anémie, dysorexie, abattement) sont absolument non spécifiques ! Il faut garder à l’esprit les autres pathologies infectieuses évoquées dans le cadre du syndrome piro-like mais aussi d’autres affections, parasitaires (cyathostomose) ou bactériennes (gourme en début d’évolution ou pleuropneumonie).
2. L’ehrlichiose ou anaplasmose
a. Etiologie et épidémiologie
L’ehrlichiose ou anaplasmose granulocytaire (à ne pas confondre avec l’ehrlichiose monocytaire ou Potomac Horse Fever) est causée par une rickettsie : Anaplasma phagocytophillum, transmises par les tiques. Elle infecte les polynucléaires neutrophiles et éosinophiles. Dans les régions endémiques, de nombreux chevaux sont séropositifs sans présenter aucun signe clinique.
b. Signes cliniques
Des infections expérimentales ont permis de reproduire la maladie et d’ainsi préciser la cinétique des différents évènements. L’incubation est de 3 à 10 jours lors d’infection expérimentale, elle pourrait aller jusqu’à 20 jours après morsure de tique sur des cas de terrain. Les symptômes sont peu spécifiques : fièvre, abattement, dysorexie, œdème des membres, difficultés à se déplacer, faiblesse, ataxie, ictère, pétéchies, uvéite… La maladie est normalement auto-limitante, c’est-à-dire que l’animal guérit sans traitement en 10 à 15 jours. De rares décès suite à une coagulation vasculaire disséminée (CIVD) sont décrits.
c. Examens complémentaires
– Analyses hémato-biochimiques
La numération formule sanguine peut révéler une neutropénie, lymphopénie, thrombopénie et de l’anémie. Une augmentation de la bilirubine conjuguée peut être observée.
– Frottis sanguin
2 à 3 jours après le début de fièvre et pendant environ 7 jours, il peut arriver d’observer une morula dans le cytoplasme des polynucléaires neutrophiles ou éosinophiles. La sensibilité de ce test reste très faible.
– Sérologie
Les anticorps apparaissent en moyenne en 15 jours suivant l’infection (d’où l’intérêt de deux sérologies réalisées à 15 jours d’intervalle) et persistent jusqu’à 1 an. Leur production peut être stoppée ou retardée par un traitement aux tétracyclines.
– PCR
La PCR est très sensible et doit être réalisée idéalement en phase fébrile. Elle est précoce, puisque lors d’infections expérimentales, les chevaux étaient positifs dès 2 à 3 jours avant le début des signes cliniques et le restaient jusqu’à 4 à 9 jours après la fin de la fièvre.
d. Traitement
L’oxytétracycline pendant 5 à 7 jours à raison de 7 mg/kg IV SID est efficace pour réduire la sévérité et la durée des signes cliniques, même si la maladie est auto-limitante sans traitement sur des chevaux infectés expérimentalement.
3. La leptospirose
a. Etiologie et épidémiologie
La leptospirose est une zoonose due à une bactérie spirochète capable de survivre durablement dans le milieu extérieur, qui se transmet via les muqueuses ou la peau lésée. Les animaux domestiques et sauvages (rongeurs en particulier) constituent le réservoir de la maladie en excrétant le pathogène dans leurs urines. La classification des leptospires est complexe, il existe plus de 22 espèces dont 10 pathogènes et plus de 300 sérovars regroupés en 24 sérogroupes. Il existe une grande variabilité selon les régions. Les études sérologiques ont montré une exposition fréquente des chevaux aux leptospires (jusqu’à 80% des chevaux seraient positifs dans certaines régions) alors que les cas cliniques documentés sont rares.
b. Signes cliniques
Les organes cibles de la bactérie sont principalement : les reins, le foie, l’œil, l’appareil reproducteur femelle, les poumons, le système nerveux central. Une bactériémie hyperthermisante de 2 à 20 jours est décrite pour certaines souches pathogènes.
L’incubation peut durer de 3 jours à 3 semaines. Les signes cliniques sont très variables et liés à l’(aux) organe(s) atteint(s) :
– uvéite (à médiation immune) : forme clinique la plus connue, d’apparition tardive (12 à 24 mois plus tard) par rapport à l’infection, elle peut se manifester de façon aigüe ou récurrente,
– formes abortives (fin gestation) et périnatales (mortalité, faiblesse/ictère) : problèmes bien décrits chez les bovins et porcins, moins bien documentés chez le cheval.
– Plus rarement : affection rénale aigüe chez le poulain ou l’adulte (fièvre, pétéchies, anémie, ictère, hématurie, azotémie…), affection hépatique aigüe ou subaigüe, hémorragies pulmonaires associées chez poulains / adultes.
Le plus souvent, l’infection reste asymptomatique.
c. Examens complémentaires
– Sérologie
Les anticorps apparaissent en 7 à 10 jours et peuvent persister longtemps (en moyenne 6 mois, parfois plus de 2 ans chez le cheval). Il existe deux techniques sérologiques : l’ELISA et le MAT (Micro Agglutination Test). L’ELISA est une technique rapide, simple, automatisée mais qui ne permet pas de distinguer les différents sérovars et ne mesure que les IgG. La technique MAT teste la capacité du sérum à agglutiner des souches vivantes de leptospires. Il s’agit de la technique de référence, elle permet de détecter le(s) sérovar(s) impliqué(s) mais elle reste longue, complexe et opérateur-dépendante. Les résultats sont données sous forme de titre (qui correspond à l’inverse de la plus haute dilution pour laquelle 50% des leptospires ont agglutiné (par rapport au contrôle). L’idéal pour le diagnostic d’un cas aigu est de réaliser une cinétique (deux sérologies à 10-15 jours d’intervalle). Lors d’avortement, les taux d’anticorps sont généralement très élevés. Au contraire, lors d’uvéite la sérologie peut rester négative malgré une origine leptospirosique (les signes cliniques étant alors retardés par rapport à l’infection).
– PCR
Pendant les 12 premiers jours de l’infection, la PCR peut être positive dans le sang, le lait, et le LCR (mais la présence du pathogène est transitoire). Après les 10 premiers jours, l’urine sera le prélèvement de choix, mais l’excrétion est intermittente (l’idéal est alors de mélanger 3 prélèvements, après administration de diurétique). Après un avortement, la PCR peut être positive jusqu’à 14 semaines. Elle peut aussi être réalisée sur les organes atteints : oeil, LCR, avorton…
d. Traitement
Les données sont principalement extrapolées d’autres espèces et l’efficacité de ces traitements chez le cheval est peu connue. D’autre part, l’utilité d’un traitement sur une forme chronique peut se discuter. La pénicilline (10 000 UI/kg BID) reste le traitement de choix. Les tétracyclines (oxytetracycline, doxycycline) peuvent également être utilisées. La durée du traitement est en général de 7 à 15 jours. Sur une uvéite, un traitement antibiotique n’est pas indiqué. Par contre, il se justifie chez une jument en fin de gestation qui présente une séroconversion afin de prévenir l’avortement et la mortalité néonatale. Il n’y a pas de données sur l’effet des antibiotiques sur la séroconversion chez cheval.
4. La borréliose ou maladie de Lyme
a. Etiologie et épidémiologie
La maladie de Lyme est une affection causée par Borrelia burgdorferi sensus lato, un ensemble de bactéries spirochète gram négative de répartition mondiale. Deux consensus ont récemment été publiés à ce sujet par l’ACVIM, pour le cheval d’une part et les carnivores domestiques d’autre part. Borrelia burgdorferi sensus stricto est l’agent causal initialement décrit en Amérique du Nord, mais d’autres sous-espèces telles que Borrelia garinii ou afzelii sont aussi retrouvées en Europe et en Asie. La bactérie est transmise par les tiques qui doivent être attachées au minimum 24h pour pouvoir entrainer une infection chez les mammifères. La séroprévalence varie selon la zone géographique concernée et la méthode sérologique utilisée, elle serait de 12 à 48% en France.
b. Signes cliniques
De nombreux signes cliniques ont été attribués à la maladie de Lyme, tels qu’une fièvre légère, de l’abattement, une raideur généralisée, des boiteries intermittentes ou variant d’un membre à l’autre, des distensions synoviales, des troubles du comportement, une fonte musculaire ou encore de l’hyperesthésie. Les études rétrospectives ayant mis en relation les chevaux séropositifs et la présence de ces signes cliniques n’ont pas démontré de corrélation significative. En revanche, il existe peu de doute sur le fait que la plupart des chevaux infectés ne présentent pas de manifestation clinique évidente.
Expérimentalement, l’infection de poneys par B. burgdorferi a entrainé une réaction cutanée et musculaire au site de morsure de la tique, ou encore une atteinte des nerfs périphériques et peri-synoviaux mais aucun signe d’atteinte générale n’a été mis en évidence. Les syndromes correctement documentés attribués aux infections naturelles à B. burgdorferi sont rares et probablement sous-diagnostiqués : uvéite, neuroborréliose, ou atteinte cutanée de type « pseudolymphome ».
c. Examens complémentaires
– Sérologie
Les tests sérologiques, basés sur la détection des anticorps anti-Borrelia, sont les plus couramment réalisés. Il en existe différents types, chacun présentant des avantages et des inconvénients. Dans tous les cas, un résultat positif indique que l’animal a été exposé à la bactérie mais pas forcément qu’il souffre de la maladie de Lyme. Quelle que soit la méthode sérologique, il n’y a aujourd’hui pas de corrélation connue entre le titre en anticorps et le risque de développer la maladie. Ainsi, dans les régions endémiques, le dépistage sérologique sur des chevaux sains n’est pas recommandé.
Sur des chevaux présentant des signes compatibles avec la maladie de Lyme, il faut garder à l’esprit que des faux négatifs sont également possibles, et qu’un résultat négatif ne permet donc pas d’exclure l’hypothèse de maladie de Lyme : lors d’une infection récente, lors d’une réponse immunitaire insuffisante ou d’une réaction locale (formes nerveuses ou oculaires).
L’ELISA (Enzyme Linked Immunosorbent Assay) est une technique sensible, automatisée, qui reste la plus utilisée en première intention mais il est reconnu qu’elle manque de spécificité. Un test de confirmation est donc conseillé lors de résultat positif : le Western Blot ou immunoblot. La cinétique des anticorps est particulière puisqu’ils sont détectables seulement 4 à 6 semaines après l’infection, ils augmentent ensuite jusque 3 à 4 mois après et restent détectables pendant plusieurs mois (12 voire 18 mois), même lors de la mise en place d’un traitement. Il n’est donc pas conseillé d’utiliser l’ELISA pour suivre l’efficacité d’une antibiothérapie.
– PCR
La sensibilité et la spécificité de la PCR n’est actuellement pas connue et la technique peut varier d’un laboratoire à l’autre. Chez le cheval, la PCR est très rarement positive dans le sang. Par contre, elle peut être intéressante sur certains tissus, tels que le liquide ou la membrane synoviale, la peau et les nœuds lymphatiques loco-régionaux du site de morsure, les muscles, les liquides oculaires (notamment le vitrée), le liquide céphalorachidien et les tissus nerveux.
d. Traitement
Le traitement des chevaux asymptomatiques n’est actuellement pas recommandé, pour des raisons économiques (dépense non justifiée), sanitaires (utilisation inappropriée d’antibiotiques), et médicales (augmentation des risques d’effets secondaires). Les chevaux présentant des signes cliniques compatibles avec une maladie de Lyme, pour lesquels les autres affections potentielles ont été exclues, sont les seuls candidats avec une sérologie positive pour lesquels le traitement est justifié. Il n’existe pas de consensus sur la molécule de choix. Les tétracyclines sont les molécules les plus utilisées actuellement. Elles ont une activité anti-inflammatoire synoviale par inhibition des MMP (Matrix Metallo Proteinase), ce qui explique la réponse favorable chez un grand nombre de chevaux présentant des boiteries d’origine articulaire, qu’elles soient liées à une borréliose ou non. Le traitement le plus fréquemment décrit en pratique clinique est l’administration d’oxytetracycline (6.6 mg/kg IV q24h) pendant 5 à 7 jours, suivie par un relai à la doxycycline (10 mg/kg PO q12h) pendant 3 à 4 semaines. Elle reste néanmoins discutable étant donné les risques d’effets secondaires et de développement de résistances bactériennes.
Conclusion
Le diagnostic étiologique lors d’un syndrome « piro-like » peut s’avérer plus complexe qu’il n’y paraît (cf Tableau ci-dessus) et engendrer des frais non négligeables pour le propriétaire (compter entre 110 et 150 euros pour un bilan piro-like, hors immunoblot dont le coût additionnel est de l’ordre de 40 euros). D’une façon générale, sur un cas aiguë (cheval en hyperthermie), après avoir exclu d’autres causes infectieuses (respiratoires notamment), une PCR semble l’analyse la plus appropriée pour la piroplasmose (Babesia et Theileria), l’anaplasmose et la leptospirose (sang et urine). Par contre, pour la maladie de Lyme, 99,9% des PCR revenant négatives sur le sang, une analyse sérologique est préférable (couplage sérologie et blot). Sur les cas chroniques, les analyses sérologiques sont les plus adaptées, même si elles restent à interpréter avec précautions : un résultat positif ne traduisant qu’une exposition au pathogène, et non une maladie, la plupart de ces affections pouvant passer inaperçues. Enfin, pour réaliser une cinétique sérologique, l’idéal étant d’analyser les deux prélèvements en même temps, il est préférable de congeler le sérum du 1er prélèvement et d’envoyer les deux sérums ensembles (un tarif préférentiel est alors en général consenti par le laboratoire).
Conditions de prélèvement :
Sang total EDTA ou crins
Conservation et stabilité (si envoi différé) : 48 à 72h – T° ambiante ou réfrigéré
Interprétation :
– Sain: le cheval ne possède pas de copie défectueuse du gène responsable de la PSSM. Il n’est donc pas malade et ne transmettra pas cette maladie a sa descendance.
– Atteint hétérozygote : le cheval possède une copie normale et une copie défectueuse du gène responsable de la PSSM. Il va développer la PSSM (mutation autosomale dominante) et transmettra ce gène défectueux a la moitié de sa descendance.
– Atteint homozygote : le cheval possède deux copies défectueuses du gène responsable de la PSSM. Il développera la PSSM et transmettra ce gène défectueux a toute sa descendance.
Conditions de prélèvement :
LCR (tube sec), humeur aqueuse (tube sec), biopsies/organes (non fixés)
Conservation et stabilité (si envoi différé) : 48h – réfrigéré
Interprétation :
La PCR peut être réalisée au sein d’un prélèvement choisi en fonction de la forme clinique suspectée (LCR, humeur aqueuse, lavage broncho-alvéolaire, cytoponctions, biopsies pulmonaires/hépatiques, etc.).
La coprologie (coproscopie ou PCR) détecte rarement des oocystes, en raison de la courte durée de la période d’excrétion (21 jours approximativement, mais plus intensément les 2 à 5 premiers jours) et de la rareté des excrétions récurrentes. Les chiens ne produisent pas d’oocystes de Toxoplasma gondii, mais ils peuvent excréter dans les selles des oocystes préalablement ingérés (coprophagie ou ingestion de matières contaminées).
Le développement d’une maladie clinique est rare chez les animaux adultes, et est souvent associé à des états d’immunosuppression.
Chez les chatons, les manifestations cliniques sont dues à une inflammation hépatique, pulmonaire et nerveuse centrale, et peuvent aller jusqu’à une mort subite. Parfois, une choriorétinite est le seul signe clinique. Les chats plus âgés peuvent présenter une variété de symptômes souvent frustes, d’apparition soudaine ou progressive : fièvre, anorexie, perte de poids, ictère, myocardite, signes digestifs, respiratoires, neuro-musculaires, oculaires, etc.
Chez le chien, les signes peuvent être localisés au plan respiratoire, neuromusculaire, gastrointestinal, ou être systémiques. Le diagnostic différentiel (notamment des formes nerveuses) inclut la néosporose. La forme généralisée est plus fréquente chez des chiens de moins d’un an.
Conditions de prélèvement :
Selles (écouvillon sec rectal ou pot)
Conservation et stabilité (si envoi différé) : plusieurs jours – réfrigéré
Interprétation :
L’infection à Tritrichomonas fœtus chez le Chat est associée à des diarrhées chroniques ou récidivantes avec une colite, les animaux jeunes (< 1an), stressés ou immunodéprimés étant plus susceptibles de développer la maladie.
Les Trichomonadidés sont des parasites fragiles dans le milieu extérieur, ceux-ci ne s’enkystant pas dans l’environnement. La transmission est donc directe, par voie féco-orale (ingestion de trophozoïtes émis dans les fèces de chats infectés). La forte densité d’animaux dans les refuges et les élevages augmente donc les risques d’infection. Certains chats peuvent être porteurs asymptomatiques.
La sensibilité de la coproscopie est faible, la PCR est à privilégier.
Sérologie
Prélèvement :
Les prélèvements peuvent être du sérum ou éventuellement du plasma hépariné (éviter l’EDTA qui peut interférer avec certaines techniques ELISA), ou d’autres liquides biologiques comme le LCS ou l’humeur aqueuse. Ils peuvent être conservés une semaine à +4 °C ou 6 mois à -20 °C et être expédiés à température ambiante.
Interprétation :
Les anticorps sont détectés généralement pendant plusieurs mois après l’exposition, ce qui offre une grande fenêtre d’exploration dans le temps. Toutefois, il s’agit aussi d’un désavantage : un individu peut parfois demeurer séropositif très longtemps après le contact avec l’agent pathogène (plusieurs mois voire > 1 an), rendant l’interprétation d’un résultat délicate : la présence de ces anticorps indique-t-elle que l’agent pathogène est présent ? Oui, dans le cas où après exposition, l’agent pathogène n’est pas éliminé (cas du FIV), mais pas forcément dans le cas contraire. Puisque la sérologie ne documente qu’une exposition à un agent pathogène, un résultat positif doit être interprété avec prudence, l’exposition à cet agent ne signifiant pas nécessairement maladie. La réponse immunitaire de l’hôte au contact de l’agent pathogène peut conduire à son élimination sans que l’individu ne présente de signes cliniques.
Effectuer une cinétique d’anticorps (soit deux mesures à 2-3 semaines d’intervalle) peut aider à déterminer si l’exposition est récente ou non : la mise en évidence d’une augmentation significative (généralement x 2 à x 4) du titre indique un contact récent avec l’agent pathogène. Cela n’a d’intérêt toutefois que si les signes cliniques apparaissent en phase aiguë d’infection. La sérologie manque souvent de sensibilité en début de maladie et un contrôle sérologique 2 semaines environ après un premier résultat négatif peut être indiqué pour mettre en évidence une séroconversion, notamment si le premier échantillon a été obtenu peu de temps après l’apparition des symptômes.
Autre limite du test sérologique : l’interférence par les anticorps d’origine vaccinale ou maternelle. Cette problématique est à l’origine de difficultés d’interprétation de résultats chez des animaux vaccinés contre la leptospirose par exemple.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La sérologie est très spécifique (faux positifs rares) mais peut manquer de sensibilité, en particulier lors d’infection précoce car la séroconversion est observée seulement quelques semaines post–infection.
La PCR et la culture (méthode de référence) seront positives principalement au moment de la bactériémie.
En pratique, face à un animal symptomatique, on pourra envisager directement une PCR ou une culture, sur sang ou autres liquides biologiques suivant les signes : placenta en cas d’avortement, pertes vaginales en cas de métrite, ou sperme en cas d’infertilité. Face à un animal asympatomatique, ou lors d’un dépistage en élevage ou d’une surveillance d’un animal importé, un suivi sérologique est à envisager (associé à une PCR et une culture en cas de résultat positif).
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Une sérologie coronavirus négative rend l’hypothèse d’une PIF peu probable (10% de faux négatif notamment chez des chats avec une forme humide avancée), en revanche, un titrage sérologique élevé (ex. 1/1600 et au-delà) sera très suggestif de la maladie si la suspicion clinique est forte. Une valeur sérologique intermédiaire ne permettra pas de conclure.
Si un épanchement est présent, une PCR sur le liquide peut être réalisée (sensibilité de 80% et spécificité de 90-100%). En pratique, une charge virale forte dans l’épanchement, associée à l’ensemble des éléments cliniques et biologiques, permet de conclure à une PIF.
Avec une présentation neurologique ou oculaire, une PCR peut aussi être réalisée sur le LCR ou l’humeur aqueuse (sensibilité moyenne et spécificité > 95%). La PCR dans le sang, la rate, les noeuds lymphatiques et la moelle osseuse peut être positive chez des chats sains (charges souvent faibles dans ce cas).
En cas de doute sur l’interprétation d’un résultat positif, il peut être intéressant de réaliser en parallèle une PCR quantitative sur écouvillon rectal. Les animaux malades n’excrétant que peu ou pas de virus, une charge rectale faible ou un résultat négatif associé à la présence de virus dans un épanchement, du LCS ou même du sang constitue un critère diagnostique supplémentaire. Inversement, une charge rectale élevée doit conduire à reconsidérer l’hypothèse de PIF.
Le diagnostic de certitude reste histopathologique (immunohistochimie).
Dépistage de la PIF en élevage :
Plus de 50% des chats en élevage seraient porteurs du coronavirus ; la contamination se fait par voie orofécale, le virus pouvant survivre jusqu’à 7 semaines dans les selles. Suite à une mutation du virus, 2-5% des chats développent une PIF, mais la transmission directe du virus muté entre chats n’a jamais été démontrée.
Dans un élevage atteint, des mesures prophylactiques seront mises en place pour limiter la contagion car 70-80% des chats sains de l’élevage continuent à excréter du virus non muté de manière intermittente ou permanente. Pour repérer les chats excréteurs, une PCR sur selles peut être réalisée, accompagnée idéalement d’une sérologie sur l’ensemble des adultes en contact avec les chatons (au moins la mère des chatons concernés).
Si une mère est excrétrice, il est conseillé de sevrer les chatons dès l’âge de 3-4 semaines ou de les faire adopter par une reproductrice allaitante non excrétrice.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La transmission de Dirofilaria immitis est possible d’avril à octobre, avec un cycle long de 7 à 9 mois environ. Il est difficile de savoir le moment d’infection, les adultes pouvant vivre plusieurs années avant d’occasionner des signes cliniques (essentiellement dans les artères pulmonaires).
La microscopie (faible sensibilité) et l’imagerie cardio-pulmonaire sont utiles au diagnostic, avant la confirmation par une recherche antigénique (détection des filaires femelles adultes). Cette recherche est très spécifique. Les antigènes sont détectables uniquement à la fin de la période prépatente (environ 6 mois après l’infestation). La sensibilité est aussi très élevée. Elle est d’environ 90 % lorsqu’une femelle est circulante et de 100 % si plus d’une femelle circule. Des résultats faux négatifs sont possibles au cours de la période prépatente ou lorsque l’infestation est très faible ou encore lors de la présence exclusive de filaires mâles.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Ehrlichia canis et Anaplasma phagocytophilum :
Les anticorps sont détectables 8 jours après l’exposition initiale et 2 à 5 jours après l’apparition des morulas en circulation.
Un test négatif ne peut pas exclure une infection, en particulier dans sa phase débutante (1 ère semaine), mais aussi lors de phase chronique évoluée. Un test positif signe une exposition à l’infection qui peut être ancienne, même avec un titre élevé. Un titre en anticorps multiplié par 4 entre 2 sérums prélevés à 1 ou 2 semaines d’intervalle suggère une infection active.
Des réactions croisées sont possibles entre A. phagocytophilum et A. platys, agent de la thrombopénie cyclique infectieuse canine, et dans une moindre mesure entre A. phagocytophilum et E. canis.
Conditions de prélèvement :
Sang total, plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 24 à 48h à T° ambiante, 7 jours si réfrigéré
Interprétation :
Ce test met en évidence l’antigène p27 en circulation (protéine de la nucléocapside virale) : détection hautement sensible et spécifique de l’antigénémie (qui s’installe dans les 30 jours suivant l’exposition chez la plupart des animaux).
Un résultat antigénique positif, chez un animal asymptomatique ou présentant peu de risque d’avoir été infecté, doit être confirmé ultérieurement (la diminution de la prévalence du FeLV augmente le risque de faux-positif +/-20%) par la réalisation d’une PCR ou d’un second test antigénique (technique différente si possible).
Compte tenu de la possibilité d’infection régressive avec virémie transitoire (élimination ou possible portage latent et réactivation ultérieure du virus), un contrôle de l’antigénémie est aussi à prévoir quelques mois après le premier test positif.
Si une exposition récente ne peut être exclue, un résultat négatif doit être confirmé par un test de contrôle minimum 30 jours après le test initial (ou une PCR plus précocement).
Il n’y a pas d’interférence avec la vaccination sauf si le prélèvement est fait immédiatement après l’injection.
Conditions de prélèvement :
Sang total, plasma hépariné ou sérum (tube sec)
Conservation et stabilité (si envoi différé) : 24 à 48h à T° ambiante, 7 jours si réfrigéré
Interprétation :
Ce test met en évidence les anticorps dirigés contre des protéines virales, avec une très haute sensibilité et spécificité, malgré un risque de faux-négatifs en phase aiguë d’infection (anticorps produits dans les 60 jours post-infection pour la grande majorité des chats).
Si le résultat est positif, chez un animal asymptomatique ou qui a peu de risques d’avoir été exposé, il est recommandé de le confirmer ultérieurement par la réalisation d’une PCR ou d’un second test sérologique (technique différente si possible).
Chez un chaton, compte tenu de la présence d’anticorps maternels, des faux-positifs sont possibles pendant les 4 voire les 6 premiers mois. La PCR peut alors être utilisée pour préciser le statut de l’animal. Un résultat négatif est généralement fiable compte tenu de la faible prévalence de l’infection et de l’excellente sensibilité des tests. Toutefois, si une exposition récente au virus est suspectée, il est conseillé de répéter le test 60 jours plus tard (délai d’apparition des anticorps), ou éventuellement d’utiliser la PCR.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
La prévalence sérologique est plus importante que la prévalence clinique, et seule une faible proportion de chiens développent une leishmaniose clinique (5 à 10 %).
Diagnostic de la Leishmaniose :
– Titrage supérieur au seuil (d’au moins deux dilutions) : résultat positif traduisant une forte réponse immunitaire et confirmant le diagnostic.
– Titrage égal ou proche du seuil (par ex. supérieur d’une dilution) : résultat douteux traduisant une situation potentiellement en évolution.
– Titrage en-dessous du seuil : résultat négatif ou taux faible d’anticorps traduisant une situation stable (infection contrôlée). Une infection précoce n’est toutefois pas exclue.
Une cytologie (myélogramme, adénogramme voire lésion cutanée) ou une PCR (mêmes prélèvements) peuvent aussi être réalisées.

D’après Le Point Vétérinaire / Avril 2016 / N° 364
Suivi de la Leishmaniose :
– L’augmentation d’au moins deux dilutions du titrage en anticorps peut traduire une rechute ou une évolution péjorative de la maladie.
– Le maintien du titrage au cours du temps (même après un traitement spécifique) n’a pas de signification particulière.
– La diminution du titrage, le plus souvent associée à une amélioration clinique et une restauration progressive éventuelle des modifications biologiques, est plutôt de bon pronostic.
La cytologie et la PCR peuvent aussi être utiles pour détecter une rechute.
Un contrôle après 1 mois de traitement est recommandé afin d’objectiver la réponse au traitement à la suite de l’utilisation de l’antimoniate de méglumine. L’examen clinique est associé à un suivi de la numération-formule sanguine, du profil biochimique, de l’électrophorèse des protéines et de l’analyse d’urine incluant un rapport protéines sur créatinine urinaires (RPCU) chez les animaux atteints d’une protéinurie.
Ensuite, un contrôle est préconisé tous les 3 à 4 mois la première année, puis tous les 6 mois à 1 an lors de récupération clinique complète. Toutefois, l’animal reste porteur de parasites et peut donc présenter des rechutes.
La durée du traitement à base d’allopurinol dépend de la sévérité de la maladie, de la réponse au traitement, ainsi que de la tolérance individuelle à celui-ci. Le suivi de l’infection est fondé principalement sur la réalisation d’une analyse sérologique 6 mois après la mise en place du traitement, puis tous les 6 mois à 1 an. Il est préconisé de toujours réaliser les analyses dans le même laboratoire. L’évolution du titre sérologique est variable selon les animaux atteints. Une diminution significative peut être notée, tout comme une stagnation du titre en anticorps malgré une évolution clinique favorable.
L’arrêt de l’allopurinol peut être envisagé lorsqu’une rémission complète des signes cliniques et paracliniques est obtenue et que la sérologie est négative ou douteuse (diminution significative), mais il entraîne un risque important de rechute de la leishmaniose. Cependant, le risque de formation de calculs de xanthine n’est pas négligeable sous allopurinol. Par conséquent, la balance bénéfice/risque doit être évaluée pour chaque chien avant d’envisager l’arrêt de ce traitement. Si ce choix est fait, il est recommandé de réaliser un suivi sérologique tous les 6 mois à 1 an. Une augmentation du titre sérologique de plus de deux dilutions entre deux contrôles sérologiques doit être interprétée comme un marqueur de rechute. Une reprise du traitement complet est alors recommandée.
Les chiens cliniquement sains mais séropositifs doivent être pris en charge en fonction du titre sérologique.
– Dans le cas des chiens présentant un titre sérologique élevé (soit un titre au moins supérieur de deux dilutions par rapport au seuil de positivité) sans signe clinique associé, les avis d’experts divergent sur la question de la mise en place d’un traitement. Cette situation reste exceptionnelle puisqu’un titre sérologique élevé est dans la majeure partie des cas associé à des signes cliniques. Elle peut cependant être rencontrée chez des animaux sur le point de développer une forme clinique. En l’absence de traitement, un suivi très rapproché doit être envisagé.
– Les chiens avec un titre sérologique faible (soit un titre moins de deux fois supérieur au seuil de positivité) doivent être de nouveau testés dans les mois suivants : si le titre est stable (faible), un suivi tous les 3 à 6 mois est préconisé et aucun traitement n’est mis en place ; si le titre augmente significativement (de plus de deux dilutions), le traitement doit être envisagé.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Les IgM (immunochromatographie) augmentent dès la 1ère semaine avec un pic à 2-3 semaines post-infection. Leur détection peut refléter une infection récente/active ou une interférence avec les IgM vaccinales (jusqu’à 2 mois après la vaccination). Le MAT permet aussi, moins spécifiquement, de détecter les IgM en même temps que les IgG.
Les IgG (ELISA ou MAT) ne sont pas détectables avant 3-4 semaines post-infection et peuvent refléter une infection chronique (datant de plusieurs mois voire plus d’un an) ou une interférence avec les IgG vaccinales (jusqu’à 4-6 mois après la vaccination).
Interprétation selon le statut vaccinal d’un chien suspecté de leptospirose :
– Animaux vaccinés depuis moins de 2 mois : une interférence vaccinale est possible quel que soit le test sérologique utilisé et un résultat positif pour les IgM ou les IgG (ELISA) ne permet pas de confirmer avec certitude une leptospirose. Une PCR (urines et sang) couplée au MAT est recommandée.
– Animaux vaccinés depuis plus de 2 mois mais moins de 6 mois : un résultat positif pour les IgM confirme une leptospirose. Un résultat positif pour les IgG peut refléter une interférence vaccinale jusqu’à 6 mois. En cas de résultat négatif pour les IgM et les IgG (ELISA), une PCR (urines et sang) couplée au MAT est recommandée.
– Animaux vaccinés depuis plus de 6 mois ou non vaccinés : un résultat positif pour les IgM confirme une leptospirose. Un résultat positif pour les IgG (ELISA) est également en faveur d’une leptospirose (chronique). En cas de résultat négatif pour les IgM et les IgG (ELISA), une PCR (urines et sang) couplée au MAT est recommandée.
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
L’espèce pathogène Leptospira interrogans est divisée en plus de 260 sérovars, eux-mêmes regroupés en plus de 25 sérogroupes.
Le test d’Agglutination Microscopique (M.A.T.), réalisé avec des souches vivantes, permet une appréciation qualitative et quantitative de la réponse sérologique (détection des IgG et des IgM).
La plus haute dilution de sérum montrant encore une réaction d’agglutination avec 50% des leptospires correspond au titre rapporté dans les résultats.
Les souches employées représentent les sérogroupes estimés dominants épidémiologiquement en France.
Il est recommandé d’attendre 2-4 semaines après l’infection pour réaliser le test sérologique (risque de faux négatifs si le test est trop précoce). Un titre élevé (ex. > 1/800) est compatible avec une infection naturelle, et la spécificité augmente (70-100%) avec un titre très élevé (> 1/1600).
La mise en évidence d’une séroconversion lors d’un suivi sérologique (ex. titre multiplié par 4 deux semaines plus tard) est aussi très suggestive d’une infection récente.
On considère habituellement que le sérovar infectant correspond à celui ayant le titre le plus élevé.
Les titres sérologiques après une vaccination récente sont généralement plus faibles (néanmoins difficiles à distinguer d’une exposition/infection chronique) et tendent à se négativer après 4-6 mois (après 1 an pour une infection naturelle).
Liste des sérogroupes et sérovars testés :
AUSTRALIS : Australis (AUS), Bratislava (BRAT), Munchen (MUN); AUTUMNALIS : Autumnalis (Akiyami A) (AKI), Bim (BIM); BALLUM : Castellonis (BAL); BATAVIAE : Bataviae (BAT); CANICOLA : Canicola (CAN); GRIPPOTYPHOSA : Grippotyphosa (GRIP), Vanderhoedoni (VAN); ICTEROAEMORRHAGIAE : Copenhageni (COP), Icterohaemorrhagiae (IH); PANAMA : Mangus (MAN), Panama (PAN); POMONA : Mozdock (MOZ), Pomona (POM); PYROGENES : Pyrogenes (PYR); SEJROE : Hardjo (HJ), Saxkoebing (SAX), Sejroe (SJ), Wolffi (WOLF); TARASSOVI : Tarassovi (TAR).
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
Des faux-négatifs sont possibles chez les très jeunes animaux ou en tout début d’infection, les résultats positifs ne traduisant que la réaction (éventuellement ancienne) de l’organisme au pathogène.
En phase aiguë de l’infection (parasitémie souvent synchrone de l’hyperthermie), un examen de frottis sanguin et une PCR peuvent être réalisés.

1. La piroplasmose
a. Etiologie et épidémiologie
La piroplasmose est due à des protozoaires, parasites des globules rouges, essentiellement chez le cheval Theileria equi et Babesia caballi. A noter que d’autres espèces de piroplasmes ont été identifiées chez des chevaux. Leur transmission se fait par morsure de tiques, une transmission transplacentaire est également possible avec Theileria et Babesia (qui peuvent être à l’origine d’avortement/mortinatalité). Un portage chronique est décrit après infection : symptomatique (pour Theileria) ou asymptomatique (pour Theileria / Babesia). C’est une maladie endémique dans de nombreux pays, ce qui pose des problèmes d’exportation vers les pays indemnes.
b. Signes cliniques
La durée d’incubation varie de 10 à 19 jours pour Theileria (qui infecte d’abord les cellules mononucléées puis les globules rouges) et de 7 à 30 jours pour Babesia (qui n’infecte que les globules rouges). La tique n’est donc plus présente lorsqu’apparaissent les signes cliniques. Ceux-ci sont non spécifiques et très variables d’un cas à l’autre. La forme aiguë classique se traduit par une forte hyperthermie (supérieure à 40°C), une léthargie, de l’anorexie, des œdèmes des membres. Les muqueuses peuvent apparaître pâles, ictériques ou congestives, parfois avec des pétéchies. Une pigmenturie peut être observée (urine jaune à rouge-brun). Des cas d’uvéite bilatérale (avec hyphema) sont rapportés.
La forme chronique se traduit par un amaigrissement, de l’abattement, de la contre-performance, parfois une splénomégalie ou des œdèmes. Une forme de myopathie à médiation immune a également été rapportée (avec atrophie et dégénérescence musculaire).
c. Examens complémentaires
– Analyses hémato-biochimiques
Les modifications sont variables et non spécifiques. Sur une forme aigüe, la numération formule sanguine peut révéler une anémie et une thrombocytopénie. Lors de forme chronique, les changements sont inconstants : éventuellement anémie, neutropénie puis monocytose. Les modifications biochimiques rapportées sont : augmentation de la bilirubine totale, parfois augmentation du fibrinogène, diminution de l’albuminémie, du phosphore et du fer. Les enzymes hépatiques (PAL-ASAT-GGT) et la créatine kinase peuvent parfois augmenter.
– Frottis sanguin
Peu sensible, il permet néanmoins de poser le diagnostic si des parasites sont observés. Il est à réaliser idéalement sur sang périphérique pendant un épisode fébrile.
– Sérologie
Différents tests sérologiques existent (fixation du complément, immunofluorescence indirecte, test ELISA), dont les performances sont variables. L’ELISA de compétition est considéré comme le test le plus sensible pour détecter des porteurs chroniques. Concernant la cinétique, les anticorps apparaissent en 7 à 21 jours (variable en fonction de la technique utilisée), un pic est observé entre 1 et 3 mois, puis ils diminuent en 3 à 6 mois et peuvent persister à niveau faible si l’animal est porteur. La réalisation de deux prises de sang à environ 15 jours d’intervalle peut donc être intéressante pour confirmer une infection récente. Après traitement, on observe une diminution du taux d’anticorps avec séronégativation possible au bout de plusieurs mois chez certains chevaux pour Babesia et une élimination possible du parasite. Pour Theileria, une guérison clinique est possible mais l’animal peut rester porteur et sérologiquement positif.
– PCR (Polymerase Chain Reaction)
Technique très sensible et spécifique, la PCR permet de mettre en évidence l’acide nucléique de l’agent pathogène dans l’échantillon. Néanmoins, se pose la question de la détection des cas chroniques, l’interprétation des PCR négatives après traitement alors que la sérologie reste positive jusqu’à 24 mois n’est aujourd’hui pas élucidée. Sur des cas aigus pour lesquels la clinique et la réponse au traitement sont compatibles avec une piroplasmose, mais la PCR revient négative, il faut garder à l’esprit que la parasitémie peut être inconstante (idéalement le fait de coupler PCR et sérologies est alors intéressant) et que d’autres agents infectieux peuvent être impliqués.
d. Traitement
L’imidocarbe dipropionate (Carbesia ND) constitue le traitement de choix. La posologie est variable en fonction de l’agent et de l’objectif souhaité. Pour un traitement symptomatique, le protocole recommandé est le suivant : Babesia 2 mg/kg et Theileria 2-4 mg/kg 2 à 3 fois à 24-72h d’intervalle. Pour une clairance (en vue d’exportation vers un pays indemne) : Babesia 2 mg/kg 2 fois à 24h d’intervalle et Theileria 4 mg/kg 4 fois à 24-72h d’intervalle. De par son activité anti-cholinestérase, les effets secondaires sont fréquents et non anodins : coliques, sudation, diarrhée. Chez l’âne ou les mules, plus sensibles, il est recommandé de ne pas dépasser 2mg/kg. A noter que l’oxytetracycline 6 mg/kg IV pendant 7 jours serait actif contre Theileria (pas Babesia). Des résistances à l’imidocarbe in vivo sur certaines souches de Theileria ont été décrites ainsi qu’une baisse de sensibilité après traitements répétés in vitro.
e. Diagnostic différentiel
Les signes classiquement décrits pour la piroplasmose (fièvre, anémie, dysorexie, abattement) sont absolument non spécifiques ! Il faut garder à l’esprit les autres pathologies infectieuses évoquées dans le cadre du syndrome piro-like mais aussi d’autres affections, parasitaires (cyathostomose) ou bactériennes (gourme en début d’évolution ou pleuropneumonie).
2. L’ehrlichiose ou anaplasmose
a. Etiologie et épidémiologie
L’ehrlichiose ou anaplasmose granulocytaire (à ne pas confondre avec l’ehrlichiose monocytaire ou Potomac Horse Fever) est causée par une rickettsie : Anaplasma phagocytophillum, transmises par les tiques. Elle infecte les polynucléaires neutrophiles et éosinophiles. Dans les régions endémiques, de nombreux chevaux sont séropositifs sans présenter aucun signe clinique.
b. Signes cliniques
Des infections expérimentales ont permis de reproduire la maladie et d’ainsi préciser la cinétique des différents évènements. L’incubation est de 3 à 10 jours lors d’infection expérimentale, elle pourrait aller jusqu’à 20 jours après morsure de tique sur des cas de terrain. Les symptômes sont peu spécifiques : fièvre, abattement, dysorexie, œdème des membres, difficultés à se déplacer, faiblesse, ataxie, ictère, pétéchies, uvéite… La maladie est normalement auto-limitante, c’est-à-dire que l’animal guérit sans traitement en 10 à 15 jours. De rares décès suite à une coagulation vasculaire disséminée (CIVD) sont décrits.
c. Examens complémentaires
– Analyses hémato-biochimiques
La numération formule sanguine peut révéler une neutropénie, lymphopénie, thrombopénie et de l’anémie. Une augmentation de la bilirubine conjuguée peut être observée.
– Frottis sanguin
2 à 3 jours après le début de fièvre et pendant environ 7 jours, il peut arriver d’observer une morula dans le cytoplasme des polynucléaires neutrophiles ou éosinophiles. La sensibilité de ce test reste très faible.
– Sérologie
Les anticorps apparaissent en moyenne en 15 jours suivant l’infection (d’où l’intérêt de deux sérologies réalisées à 15 jours d’intervalle) et persistent jusqu’à 1 an. Leur production peut être stoppée ou retardée par un traitement aux tétracyclines.
– PCR
La PCR est très sensible et doit être réalisée idéalement en phase fébrile. Elle est précoce, puisque lors d’infections expérimentales, les chevaux étaient positifs dès 2 à 3 jours avant le début des signes cliniques et le restaient jusqu’à 4 à 9 jours après la fin de la fièvre.
d. Traitement
L’oxytétracycline pendant 5 à 7 jours à raison de 7 mg/kg IV SID est efficace pour réduire la sévérité et la durée des signes cliniques, même si la maladie est auto-limitante sans traitement sur des chevaux infectés expérimentalement.
3. La leptospirose
a. Etiologie et épidémiologie
La leptospirose est une zoonose due à une bactérie spirochète capable de survivre durablement dans le milieu extérieur, qui se transmet via les muqueuses ou la peau lésée. Les animaux domestiques et sauvages (rongeurs en particulier) constituent le réservoir de la maladie en excrétant le pathogène dans leurs urines. La classification des leptospires est complexe, il existe plus de 22 espèces dont 10 pathogènes et plus de 300 sérovars regroupés en 24 sérogroupes. Il existe une grande variabilité selon les régions. Les études sérologiques ont montré une exposition fréquente des chevaux aux leptospires (jusqu’à 80% des chevaux seraient positifs dans certaines régions) alors que les cas cliniques documentés sont rares.
b. Signes cliniques
Les organes cibles de la bactérie sont principalement : les reins, le foie, l’œil, l’appareil reproducteur femelle, les poumons, le système nerveux central. Une bactériémie hyperthermisante de 2 à 20 jours est décrite pour certaines souches pathogènes.
L’incubation peut durer de 3 jours à 3 semaines. Les signes cliniques sont très variables et liés à l’(aux) organe(s) atteint(s) :
– uvéite (à médiation immune) : forme clinique la plus connue, d’apparition tardive (12 à 24 mois plus tard) par rapport à l’infection, elle peut se manifester de façon aigüe ou récurrente,
– formes abortives (fin gestation) et périnatales (mortalité, faiblesse/ictère) : problèmes bien décrits chez les bovins et porcins, moins bien documentés chez le cheval.
– Plus rarement : affection rénale aigüe chez le poulain ou l’adulte (fièvre, pétéchies, anémie, ictère, hématurie, azotémie…), affection hépatique aigüe ou subaigüe, hémorragies pulmonaires associées chez poulains / adultes.
Le plus souvent, l’infection reste asymptomatique.
c. Examens complémentaires
– Sérologie
Les anticorps apparaissent en 7 à 10 jours et peuvent persister longtemps (en moyenne 6 mois, parfois plus de 2 ans chez le cheval). Il existe deux techniques sérologiques : l’ELISA et le MAT (Micro Agglutination Test). L’ELISA est une technique rapide, simple, automatisée mais qui ne permet pas de distinguer les différents sérovars et ne mesure que les IgG. La technique MAT teste la capacité du sérum à agglutiner des souches vivantes de leptospires. Il s’agit de la technique de référence, elle permet de détecter le(s) sérovar(s) impliqué(s) mais elle reste longue, complexe et opérateur-dépendante. Les résultats sont données sous forme de titre (qui correspond à l’inverse de la plus haute dilution pour laquelle 50% des leptospires ont agglutiné (par rapport au contrôle). L’idéal pour le diagnostic d’un cas aigu est de réaliser une cinétique (deux sérologies à 10-15 jours d’intervalle). Lors d’avortement, les taux d’anticorps sont généralement très élevés. Au contraire, lors d’uvéite la sérologie peut rester négative malgré une origine leptospirosique (les signes cliniques étant alors retardés par rapport à l’infection).
– PCR
Pendant les 12 premiers jours de l’infection, la PCR peut être positive dans le sang, le lait, et le LCR (mais la présence du pathogène est transitoire). Après les 10 premiers jours, l’urine sera le prélèvement de choix, mais l’excrétion est intermittente (l’idéal est alors de mélanger 3 prélèvements, après administration de diurétique). Après un avortement, la PCR peut être positive jusqu’à 14 semaines. Elle peut aussi être réalisée sur les organes atteints : oeil, LCR, avorton…
d. Traitement
Les données sont principalement extrapolées d’autres espèces et l’efficacité de ces traitements chez le cheval est peu connue. D’autre part, l’utilité d’un traitement sur une forme chronique peut se discuter. La pénicilline (10 000 UI/kg BID) reste le traitement de choix. Les tétracyclines (oxytetracycline, doxycycline) peuvent également être utilisées. La durée du traitement est en général de 7 à 15 jours. Sur une uvéite, un traitement antibiotique n’est pas indiqué. Par contre, il se justifie chez une jument en fin de gestation qui présente une séroconversion afin de prévenir l’avortement et la mortalité néonatale. Il n’y a pas de données sur l’effet des antibiotiques sur la séroconversion chez cheval.
4. La borréliose ou maladie de Lyme
a. Etiologie et épidémiologie
La maladie de Lyme est une affection causée par Borrelia burgdorferi sensus lato, un ensemble de bactéries spirochète gram négative de répartition mondiale. Deux consensus ont récemment été publiés à ce sujet par l’ACVIM, pour le cheval d’une part et les carnivores domestiques d’autre part. Borrelia burgdorferi sensus stricto est l’agent causal initialement décrit en Amérique du Nord, mais d’autres sous-espèces telles que Borrelia garinii ou afzelii sont aussi retrouvées en Europe et en Asie. La bactérie est transmise par les tiques qui doivent être attachées au minimum 24h pour pouvoir entrainer une infection chez les mammifères. La séroprévalence varie selon la zone géographique concernée et la méthode sérologique utilisée, elle serait de 12 à 48% en France.
b. Signes cliniques
De nombreux signes cliniques ont été attribués à la maladie de Lyme, tels qu’une fièvre légère, de l’abattement, une raideur généralisée, des boiteries intermittentes ou variant d’un membre à l’autre, des distensions synoviales, des troubles du comportement, une fonte musculaire ou encore de l’hyperesthésie. Les études rétrospectives ayant mis en relation les chevaux séropositifs et la présence de ces signes cliniques n’ont pas démontré de corrélation significative. En revanche, il existe peu de doute sur le fait que la plupart des chevaux infectés ne présentent pas de manifestation clinique évidente.
Expérimentalement, l’infection de poneys par B. burgdorferi a entrainé une réaction cutanée et musculaire au site de morsure de la tique, ou encore une atteinte des nerfs périphériques et peri-synoviaux mais aucun signe d’atteinte générale n’a été mis en évidence. Les syndromes correctement documentés attribués aux infections naturelles à B. burgdorferi sont rares et probablement sous-diagnostiqués : uvéite, neuroborréliose, ou atteinte cutanée de type « pseudolymphome ».
c. Examens complémentaires
– Sérologie
Les tests sérologiques, basés sur la détection des anticorps anti-Borrelia, sont les plus couramment réalisés. Il en existe différents types, chacun présentant des avantages et des inconvénients. Dans tous les cas, un résultat positif indique que l’animal a été exposé à la bactérie mais pas forcément qu’il souffre de la maladie de Lyme. Quelle que soit la méthode sérologique, il n’y a aujourd’hui pas de corrélation connue entre le titre en anticorps et le risque de développer la maladie. Ainsi, dans les régions endémiques, le dépistage sérologique sur des chevaux sains n’est pas recommandé.
Sur des chevaux présentant des signes compatibles avec la maladie de Lyme, il faut garder à l’esprit que des faux négatifs sont également possibles, et qu’un résultat négatif ne permet donc pas d’exclure l’hypothèse de maladie de Lyme : lors d’une infection récente, lors d’une réponse immunitaire insuffisante ou d’une réaction locale (formes nerveuses ou oculaires).
L’ELISA (Enzyme Linked Immunosorbent Assay) est une technique sensible, automatisée, qui reste la plus utilisée en première intention mais il est reconnu qu’elle manque de spécificité. Un test de confirmation est donc conseillé lors de résultat positif : le Western Blot ou immunoblot. La cinétique des anticorps est particulière puisqu’ils sont détectables seulement 4 à 6 semaines après l’infection, ils augmentent ensuite jusque 3 à 4 mois après et restent détectables pendant plusieurs mois (12 voire 18 mois), même lors de la mise en place d’un traitement. Il n’est donc pas conseillé d’utiliser l’ELISA pour suivre l’efficacité d’une antibiothérapie.
– PCR
La sensibilité et la spécificité de la PCR n’est actuellement pas connue et la technique peut varier d’un laboratoire à l’autre. Chez le cheval, la PCR est très rarement positive dans le sang. Par contre, elle peut être intéressante sur certains tissus, tels que le liquide ou la membrane synoviale, la peau et les nœuds lymphatiques loco-régionaux du site de morsure, les muscles, les liquides oculaires (notamment le vitrée), le liquide céphalorachidien et les tissus nerveux.
d. Traitement
Le traitement des chevaux asymptomatiques n’est actuellement pas recommandé, pour des raisons économiques (dépense non justifiée), sanitaires (utilisation inappropriée d’antibiotiques), et médicales (augmentation des risques d’effets secondaires). Les chevaux présentant des signes cliniques compatibles avec une maladie de Lyme, pour lesquels les autres affections potentielles ont été exclues, sont les seuls candidats avec une sérologie positive pour lesquels le traitement est justifié. Il n’existe pas de consensus sur la molécule de choix. Les tétracyclines sont les molécules les plus utilisées actuellement. Elles ont une activité anti-inflammatoire synoviale par inhibition des MMP (Matrix Metallo Proteinase), ce qui explique la réponse favorable chez un grand nombre de chevaux présentant des boiteries d’origine articulaire, qu’elles soient liées à une borréliose ou non. Le traitement le plus fréquemment décrit en pratique clinique est l’administration d’oxytetracycline (6.6 mg/kg IV q24h) pendant 5 à 7 jours, suivie par un relai à la doxycycline (10 mg/kg PO q12h) pendant 3 à 4 semaines. Elle reste néanmoins discutable étant donné les risques d’effets secondaires et de développement de résistances bactériennes.
Conclusion
Le diagnostic étiologique lors d’un syndrome « piro-like » peut s’avérer plus complexe qu’il n’y paraît (cf Tableau ci-dessus) et engendrer des frais non négligeables pour le propriétaire (compter entre 110 et 150 euros pour un bilan piro-like, hors immunoblot dont le coût additionnel est de l’ordre de 40 euros). D’une façon générale, sur un cas aiguë (cheval en hyperthermie), après avoir exclu d’autres causes infectieuses (respiratoires notamment), une PCR semble l’analyse la plus appropriée pour la piroplasmose (Babesia et Theileria), l’anaplasmose et la leptospirose (sang et urine). Par contre, pour la maladie de Lyme, 99,9% des PCR revenant négatives sur le sang, une analyse sérologique est préférable (couplage sérologie et blot). Sur les cas chroniques, les analyses sérologiques sont les plus adaptées, même si elles restent à interpréter avec précautions : un résultat positif ne traduisant qu’une exposition au pathogène, et non une maladie, la plupart de ces affections pouvant passer inaperçues. Enfin, pour réaliser une cinétique sérologique, l’idéal étant d’analyser les deux prélèvements en même temps, il est préférable de congeler le sérum du 1er prélèvement et d’envoyer les deux sérums ensembles (un tarif préférentiel est alors en général consenti par le laboratoire).
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
L’augmentation des IgG survient généralement à partir de la deuxième semaine post-infection, mais prend parfois jusqu’à 6 semaines. Après le début de la production des IgG, le pic est atteint en 2 ou 3 semaines, ce qui laisse une petite fenêtre pour documenter une séroconversion significative entre deux analyses (infection active).
Les titres élevés peuvent persister pendant plusieurs années, ce résultat indique juste la présence de T. gondii dans l’organisme, mais pas nécessairement une infection active.
La présence d’anticorps ne signe pas la maladie mais le contact de l’animal avec le parasite.
La PCR peut aussi être réalisée au sein d’un prélèvement choisi en fonction de la forme clinique suspectée (humeur aqueuse, LCR, lavage broncho-alvéolaire, cytoponctions, biopsies pulmonaires/hépatiques, etc.).
Conditions de prélèvement :
Sérum (tube sec)
Conservation et stabilité (si envoi différé) : plusieurs jours – T° ambiante ou réfrigéré
Interprétation :
L’augmentation des IgG survient généralement à partir de la deuxième semaine post-infection, mais prend parfois jusqu’à 6 semaines. Après le début de la production des IgG, le pic est atteint en 2 ou 3 semaines, ce qui laisse une petite fenêtre pour documenter une séroconversion significative entre deux analyses (infection active).
Les titres élevés peuvent persister pendant plusieurs années, ce résultat indique juste la présence de T. gondii dans l’organisme, mais pas nécessairement une infection active.
La présence d’anticorps ne signe pas la maladie mais le contact de l’animal avec le parasite.
La PCR peut aussi être réalisée au sein d’un prélèvement choisi en fonction de la forme clinique suspectée (humeur aqueuse, LCR, lavage broncho-alvéolaire, cytoponctions, biopsies pulmonaires/hépatiques, etc.).
La coproscopie est peu utile (aléatoire et souvent négative mais la sensibilité est nettement améliorée par une recherche PCR dans les selles).
Cas particulier du chat :
Des enquêtes de séroprévalence indiquent qu’une forte proportion de chats sont positifs et qu’elle augmente avec l’âge et le mode de vie (accès à l’extérieur).
Quel que soit le résultat sérologique, il est nécessaire de considérer le chat comme potentiellement dangereux pour la femme enceinte (même s’il ne représente pas, au moins en France, la source majeure de contamination). Une sérologie négative indiquera probablement une absence d’immunité protectrice du chat (avec risque d’infection et d’excrétion d’ookystes). Une sérologie positive indique le plus souvent une immunité efficace chez le chat. Toutefois, cette immunité peut aussi être faillible (surtout si infection récente avec excrétion d’ookystes, jeune chat primo-infecté, comorbidités, immunodéficience, etc.).
Cytologie : prélèvement et interprétation
1. Prélèvement (par ponction avec et sans aspiration, impression, grattage et écouvillon) :
Une bonne contention de l’animal est nécessaire.
Dans certains cas, une sédation devrait être utilisée si le site de prélèvement est situé près de structures délicates (ex. ponction hépatique), ou si l’animal est agité voire agressif. Une anesthésie générale peut être recommandée lorsqu’une immobilité complète est nécessaire (ex. : ponction de moelle osseuse). Pour une ponction cutanée, le site doit être propre et un léger nettoyage avec un tampon d’alcool est généralement suffisant. Une préparation chirurgicale du site de ponction devrait être effectuée si une culture bactériologique est envisagée ou si une cavité corporelle est pénétrée (ex. thorax, abdomen, articulation). La ponction à l’aiguille fine sans aspiration est la technique de choix pour la majorité des masses cutanées ainsi que pour de nombreux autres sites et tissus. Elle s’effectue par simple ponction de la lésion en utilisant une technique sans aspiration (avec aiguille démontée) ou une technique avec aspiration en employant une seringue attachée à l’aiguille. Les calibres d’aiguille recommandés sont de 21-G à 23- G, le calibre 22-G étant adéquat dans la majorité des cas (photo 1).

Le prélèvement s’effectue par l’exécution de nombreux mouvements de « va-et-vient » afin d’introduire des cellules et des fragments tissulaires dans l’aiguille. Il est recommandé de changer l’orientation de l’aiguille plusieurs fois au cours du prélèvement (photos 2). Pour des lésions dont le diamètre excède 1,5 cm, plusieurs parties de la lésion devraient être ponctionnées afin d’obtenir un échantillon plus représentatif. Enfin, lors du prélèvement « va-et-vient », il faut veiller à ne pas faire sortir l’aiguille de la lésion afin d’éviter que l’échantillon ne soit contaminé par des cellules cutanées ou adipeuses.

Un prélèvement par aspiration peut être utilisé si la ponction avec aiguille démontée ne permet pas d’obtenir un échantillon suffisamment cellulaire. La lésion est d’abord ponctionnée avec une aiguille fixée à une seringue dont le piston est préalablement rempli d’air (2 à 5 ml). La présence d’air dans la seringue permet d’éjecter rapidement l’échantillon contenu dans l’aiguille, de façon à éviter que la formation d’un caillot ne séquestre les cellules à examiner. Une fois le tissu pénétré, une pression négative est exercée à plusieurs reprises en retirant le piston jusqu’au 3/4 du volume de la seringue pour favoriser le détachement cellulaire/tissulaire. Une pression négative excessive doit être évitée pour ne pas rompre les vaisseaux environnants et ainsi causer une contamination sanguine périphérique. Comme pour la méthode sans aspiration, il est recommandé de changer l’orientation de l’aiguille dans le but d’obtenir un échantillon représentatif de la lésion.
Les impressions et les grattages peuvent être utilisés pour échantillonner des lésions cutanées superficielles, ou des lésions profondes obtenues en chirurgie ou en nécropsie.
Les impressions de lésions cutanées s’effectuent simplement en y apposant une lame et en exerçant une légère pression de telle sorte que les cellules adhèrent par capillarité. Pour un prélèvement à partir d’une biopsie, une nouvelle coupe dans le tissu est préparée et l’excès de fluides tissulaires et de sang est épongé à l’aide de papier absorbant. On prélève ensuite une petite section du tissu que l’on applique à plusieurs reprises sur la surface d’une lame de verre que l’on fait ensuite sécher à l’air libre.
Les grattages cutanés peuvent se réaliser au moyen d’une lame de bistouri émoussée en effectuant des mouvements de façon unidirectionnelle et perpendiculairement à la surface de la lésion. Le matériel récolté est ensuite déposé sur une lame de verre puis étalé. Idéalement, le grattage doit être suffisamment profond pour provoquer une exsudation de fluides tissulaires ou un léger saignement à la surface de la peau. L’impression est une méthode de prélèvement appropriée pour la recherche et l’identification de micro-organismes (bactéries, spores et hyphes fongiques). Le grattage est une technique particulièrement indiquée pour les lésions sèches et sans relief ou au niveau de certaines surfaces (ex. cornée ou conjonctive après anesthésie locale). Lors d’impression et de grattage, les couches cellulaires superficielles sont souvent les seules à être échantillonnées. De ce fait, les cellules plus profondes peuvent ne pas être représentées avec ces techniques, ce qui peut mener à un diagnostic erroné ou incomplet.
L’écouvillon est essentiellement utilisé pour les lésions fistuleuses, le canal auriculaire, les passages nasaux, les lésions de la cavité orale et le tractus génital externe (détermination du stade du cycle reproducteur). Il est légèrement humecté avec de la saline stérile, puis roulé ou frotté contre la surface à échantillonner. Le matériel est déposé sur une lame (par roulement) pour l’examen cytologique. Cette technique est peu utile pour le diagnostic de conditions néoplasiques.
2. Etalement de l’échantillon sur lame, séchage et coloration :
L’étalement de l’échantillon sur la lame doit se faire rapidement pour éviter que l’échantillon ne coagule ou ne se dessèche.
Il devrait fournir une couche monocellulaire constituée de cellules intactes pour permettre un examen cytologique optimale. Après le prélèvement, le contenu de l’aiguille est éjecté sur une lame de verre propre sur laquelle une deuxième lame est déposée délicatement et perpendiculairement à la première (photos 1 et 2 ci-dessous). L’échantillon est étalé en faisant glisser les deux lames l’une par rapport à l’autre. Idéalement, l’éjection du matériel doit se faire doucement et à proximité de la lame pour éviter une dispersion en « éclat d’obus » difficile à étaler (photo 3 ci-dessous). Il est important de ne pas appliquer une pression trop forte afin d’éviter une éventuelle rupture cellulaire. Certaines cellules, comme les lymphocytes néoplasiques, sont particulièrement fragiles et peuvent facilement se rompre au moment de l’étalement. La présence de nombreux noyaux libres sans cytoplasme, avec une grande quantité de filaments nucléaires, s’observent fréquemment si l’étalement a été effectué avec trop de pression (photos 4 et 5 ci-dessous). La présence d’une proportion importante de cellules éclatées est une cause fréquente d’échantillons non diagnostiques.
Le séchage de la lame contenant le matériel étalé doit se faire rapidement, en agitant la lame au contact de l’air.
Plusieurs lames devraient être préparées pour chaque lésion prélevée. Une ou deux lames d’une série peuvent être colorées et examinées au microscope par le praticien pour évaluer la cellularité de l’échantillon, la qualité de l’étalement et pour obtenir un diagnostic préliminaire. Les colorants de type rapide comme le Diff-Quick ou le RAL sont généralement utilisés pour la coloration cytologique de routine. Les lames colorées et non colorées sont ensuite envoyées au laboratoire dans une protection rigide (sans déposer de lamelle sur les lames à examiner).

Conditions de prélèvement :
Les liquides doivent être placés dans un tube EDTA (sauf LCS tube sec), expédiés au laboratoire sous 2-3 jours (sauf LCS sous 24h), et maintenus au frais jusqu’à l’envoi. Si une bactériologie/mycologie est demandée conjointement, un tube sec devra être joint. Les PCR éventuelles seront réalisées sur le tube EDTA.
Une quantité suffisante de liquide (minimum 1-2 ml) est nécessaire pour la préparation de lames par cytocentrifugation, et pour la détermination du comptage cellulaire et du taux protéique au laboratoire.
Afin de préserver la morphologie des cellules contenues dans le liquide, deux manipulations peuvent être réalisées à la clinique :
1. Envoi au laboratoire de lames réalisées rapidement après avoir récolté le liquide.
Si le liquide apparaît opaque et de cellularité élevée (ex. péritonite, arthrite), un frottis direct peut être effectué.
Si le liquide semble peu cellulaire (ex. lavage), une partie de celui-ci peut être centrifugée (dans un tube à fond conique si possible) : les cellules concentrées au niveau du culot sont ensuite prélevées avec une pipette en plastique (en retirant le surnageant et en laissant 0.25 – 0.5 ml dans le fond du tube), puis déposées sur une lame et étalées comme un frottis.
2. Pour les liquides cérébrospinaux, il est possible d’ajouter du sérum du même animal (autologue) directement dans le liquide récolté (environ 10% du volume de l’échantillon récolté soit généralement 2-3 gouttes de sérum). Ce liquide pourra ensuite être envoyé au laboratoire pour réaliser l’examen cytologique. Un second tube contenant le LCS non modifié (sans ajout de serum) sera nécessaire pour la détermination du taux protéique et du comptage cellulaire.
Histopathologie : prélèvement et interprétation
Les bonnes pratiques d’utilisation du formol
Le formol tamponné permet de fixer les tissus histologiques. Il s’agit d’un produit chimique irritant pour la peau, les muqueuses oculaire et respiratoire en cas de contact direct ou par inhalation. Il peut être responsable de dermatites de contact d’irritation ou allergique et d’asthme professionnel. Il pourrait présenter un risque cancérogène chez des personnes fortement exposées au formaldéhyde (source : inrs.fr)
Précautions à prendre lors de la manipulation du formol
- Protection cutanée & oculaire : port de gants nitrile et de lunettes étanches.
- Protection corporelle : port d’une blouse fermée, voire en plus, d’un tablier en plastique.
- Protection respiratoire : port d’un demi-masque à usage unique.
- Table de travail : la manipulation doit se faire dans une pièce correctement ventilée ou dans des conditions optimales sous une hotte aspirante.
Pour plus de détails, vous pouvez consulter La Fiche de Données Sécurité Formol & Le Mode d’emploi
Conseils pour le stockage et l’envoi
Les pots doivent être stockés à l’abri de la lumière, dans un lieu ventilé, entre 5 et 25°C. Ils doivent être utilisés avant la date de péremption imprimée sur le flacon.
Il est important de respecter les bonnes pratiques d’emballage afin d’éviter toute fuite pendant le transport.

Des alternatives au formol ?
Les substituts disponibles sur le marché français ne présentent pas les mêmes qualités techniques et les risques liés à leur utilisation sont encore mal connus.
Néanmoins, il existe des pots sécurisés permettant de limiter l’exposition du manipulateur. VETODIAG propose des pots SAFECAPSULE à prix coûtant. Ceux-ci existent en 2 formats : 250 mL à 4.50 euros TTC/pot et 60 mL à 2 euros TTC/pot. Leur mode d’emploi est disponible ici.
La valeur du diagnostic sur pièce d’exérèse est déterminée par différents facteurs, notamment une taille adaptée, une localisation judicieuse du site de prélèvement et une fixation de bonne qualité.
Pour les prélèvements dont la taille est inférieure à 2 cm de diamètre, la pièce d’exérèse est envoyée dans son intégralité.
Une pièce plus volumineuse doit être préalablement sectionnée. En effet, le formol ne pénètre le tissu que dans une faible épaisseur (environ 1 cm pour du tissu compact).
Le prélèvement envoyé doit systématiquement inclure la zone de transition entre le tissu sain et le tissu lésionnel, quelle que soit la suspicion clinique ou la localisation de la lésion. En effet, l’examen de cette région de transition est capital car c’est là où siègent les lésions les plus récentes (et les plus spécifiques) du processus pathologique en cours. Dans le cas d’une lésion de nature tumorale, cette zone périphérique fournit de nombreuses informations, notamment sur la malignité de la tumeur (caractère infiltrant, emboles, etc.). De même, en cas de suspicion de malignité, et lorsqu’il peut être prélevé, le nœud lymphatique de drainage est joint afin d’établir le bilan d’extension histologique ganglionnaire.
Les pièces d’exérèse doivent être placées dans un flacon contenant du formol (solution commerciale tamponnée de formaldéhyde à 10 %). Il est fondamental de respecter un rapport d’au moins 10 entre le volume de formol et celui de la pièce à fixer. Dans un prélèvement mal fixé, le processus d’autolyse se poursuit, ce qui rend difficile son traitement technique et altère la qualité du diagnostic (dégradation de la morphologie cellulaire, développement bactérien).
Informations extraites de l’article « Comment optimiser un prélèvement histologique ou cytologique » Le Point Vétérinaire n° 316 du 01/06/2011
- Nombre de biopsies
Quelles que soient la lésion et sa localisation (cutanée, hépatique, rénale, intestinale), la multiplication des zones de biopsie permet d’augmenter les chances que le prélèvement examiné soit représentatif du processus pathologique en cours et de la totalité des structures histologiques de l’organe.
- Taille des biopsies
Les biopsies doivent être de la plus grande taille possible et inclure des zones représentatives. En effet, souvent, elles sont trop superficielles et ne ciblent pas les lésions d’intérêt permettant d’établir le diagnostic. C’est pourquoi, dans la mesure du possible (localisation de la lésion, état général de l’animal, hypothèses cliniques, temps, matériel), la biopsie doit comprendre les structures histologiques essentielles de l’organe. La peau, le rein et le foie se prêtent aux prélèvements de plus grande taille (1 à 2 cm de diamètre), à condition d’avoir exclu une coagulopathie et de suturer le lieu de la biopsie.
- Profondeur et localisation des biopsies
Lorsque la lésion à biopser mesure plus de 1 cm de diamètre, il est possible que le centre, nécrosé ou fibrosé, ne présente que peu d’intérêt diagnostique. Des prélèvements doivent donc être effectués, si possible, en périphérie, notamment dans la zone de transition entre le tissu lésionnel et le tissu sain. Cette région renseigne sur le caractère infiltrant ou non du processus, et sur la présence éventuelle d’emboles vasculaires pour les processus néoplasiques. Lors de biopsie cutanée, il convient de prélever également une zone saine (à moins que la lésion d’intérêt ne soit diffuse), afin de bénéficier d’un contrôle interne et de permettre au pathologiste de distinguer l’aspect physiologique de l’aspect pathologique.
- Quand pratiquer une biopsie ?
Il est souhaitable de réaliser les biopsies le plus précocement possible et sur les lésions les plus récentes. Ces dernières, souvent les plus représentatives, sont localisées en périphérie, à la frontière avec le tissu sain. Les lésions chroniques sont souvent peu spécifiques : les phases précoces du processus pathologique, souvent spécifiques et riches en informations, ont parfois disparu, laissant place à des remaniements tissulaires importants non représentatifs.
La biopsie est souvent proposée comme un examen de deuxième intention, parfois après la mise en place d’une thérapeutique susceptible de modifier l’aspect lésionnel de certains organes. L’arrêt de tout traitement 15 jours avant l’opération est conseillé.
- Limites des biopsies
Le prélèvement par biopsie est certes rapide et peu invasif, mais, pour certains organes, des prélèvements de plus grande taille, voire, parfois, une exérèse de l’organe entier sont préférables. Par exemple, les biopsies hépatiques larges permettent au pathologiste de mieux apprécier l’architecture du foie et d’affiner considérablement le diagnostic. Les biopsies ganglionnaires sont souvent peu lisibles et parfois non conclusives. De plus, certaines lésions ne se prêtent pas à un prélèvement par biopsie. C’est le cas souvent des tumeurs mammaires, surtout chez le chien (en raison de leur fréquente hétérogénéité) et des tumeurs péri-anales hépatoïdes. Le caractère infiltrant de la lésion visible sur la pièce d’exérèse complète constitue un critère décisif de malignité de la tumeur.
Informations extraites de l’article « Comment optimiser un prélèvement histologique ou cytologique » Le Point Vétérinaire n° 316 du 01/06/2011
Rate :
Si la rate est trop volumineuse, des échantillons des lésions peuvent être sélectionnés pour l’analyse histologique. Certaines néoformations spléniques sont fortement hémorragiques ou nécrotiques. L’échantillonnage de ces lésions particulières doit alors impérativement concerner la jonction entre le tissu splénique périphérique et cette lésion. La multiplicité des échantillons permet de s’assurer de la faisabilité de l’analyse.
Ne pas mélanger des petits échantillons biopsiques avec des fragments de rate, ceux-ci pourraient se retrouver perdus au milieu du coagulum sanguin émanant du tissu splénique.
Chaîne mammaire chez les carnivores domestiques :
Si la chaîne mammaire entière ou demi-chaîne mammaire ne peuvent-être transmises en raison de leur grande taille, un échantillonnage des lésions nodulaires ou en plaque pourra être réalisé. Les zones dévitalisées ou fortement hémorragiques devront être évitées si possible lors de l’échantillonnage ou bien l’échantillonnage devra alors intéresser la jonction entre ces zones et le tissu mammaire en périphérie.
Les nœuds lymphatiques à évaluer et/ou à transmettre si accessibles sont les suivants en fonction de mamelles impliquées :
Chien M1 thoracique, M2 thoracique : nœuds lymphatiques axillaire et sternaux
Chien M3 abdominal crânial : nœuds lymphatiques axillaire, inguinal superficiel et iliaques médiaux
Chien M4 abdominal caudal : nœuds lymphatiques axillaire et inguinal superficiel
Chien M5 inguinal : nœuds lymphatiques inguinal superficiel et poplité
Meuten, D.J. 2017. Tumors in Domestic animals, 5th ed. Wiley Blackwell.
Chat M1 thoracique, M2 thoracique : nœuds lymphatiques axillaire et sternaux
Chat M3 abdominal : nœuds lymphatiques axillaire, sternaux et inguinal superficiel
Chat M4 inguinal : nœud lymphatique inguinal superficiel
Meuten, D.J. 2017. Tumors in Domestic animals, 5th ed. Wiley Blackwell.
Testicules :
Le testicule le plus gros n’est pas toujours le testicule anormal. C’est pourquoi lors de différence de taille des testicules à l’examen clinique, le terme de dissymétrie testiculaire est préféré aux qualificatifs d’hypertrophie ou atrophie. C’est également pour cette raison qu’il est recommandé de transmettre les deux testicules pour analyse histologique. Par ailleurs il convient de souligner que certaines tumeurs testiculaires restent microscopiques et non visibles à la macroscopie, notamment celles qui restent confinées au tubes séminifères (par exemple séminome intra-tubaire).
Peau :
Un minimum de trois biopsies cutanées est conseillé pour s’assurer de la représentativité des échantillons.
Si la dermatose ne répond pas aux traitements qui semblaient les plus appropriés, les biopsies sont à réaliser si possible dans les trois semaines après le début des symptômes.
Les traitements glucocorticoïdes doivent de préférence être stoppés minimum deux semaines avant le prélèvement.
Les infections secondaires doivent être préalablement traitées avant de réaliser les biopsies.
Les croûtes et squames ne doivent pas être enlevées car ils apportent parfois des informations importantes pour le diagnostic (par exemple teigne superficielle ou cellules acantholysées lors de pemphigus foliacé).
Les biopsies sont en général recoupées en leur centre au laboratoire. Les papules, pustules, petites lésions doivent donc se trouver au centre de la biopsie.
Il est important de manipuler le moins possible la biopsie avec les pinces/clampes pour éviter les artéfacts d’écrasement. La biopsie doit-être doucement épongée pour enlever l’excès de sang lié à l’acte biopsique. La biopsie doit-être plongée le plus rapidement possible dans le tube de formol pour éviter l’autolyse.
Les sites à biopsier peuvent être tondus doucement sans toucher la surface cutanée. La zone à prélever peut-être nettoyée avec de l’alcool à 70% mais ne doit pas être scrubbée ni désinfectée avec des antiseptiques iodophores.
Pour les chevaux, la prophylaxie anti-tétanique est de rigueur avant l’acte biopsique.
Les trépans généralement utilisés pour les chevaux et carnivores domestiques ont un diamètre de 6 mm ou 8 mm. Les trépans de 4 mm sont utilisés pour les zones peu accessibles ou risquant de générer des cicatrices ou de la douleur comme les coussinets, la truffe. Les zones prélevées sont ensuite suturées après hémostase et désinfection.
Lésions/sites particuliers :
– Dermatite bulleuse, pustuleuse ou vésiculeuse : afin de préserver ces lésions et observer une éventuelle acantholyse (maladies pemphigoïdes), il faut privilégier les biopsies au scalpel en « côte de melon » plutôt que celles au trépan (biopsy punch).
– Dermatose alopéciante : privilégier les zones les plus alopéciques ou de pelage anormal, incluant si elles existent les zones de lichénification, d’hyperpigmentation ou d’éventuelles calcinose. Si une origine héréditaire est suspectée lors de maladie affectant le pelage, une biopsie en zone normale en plus des autres biopsies peut alors être recommandée.
Cas particulier de l’alopecia aerata : des échantillons doivent être prélevés du centre vers la périphérie de la zone alopécique.
Cas particulier de l’alopécie associée à une démodécie ou teigne : les échantillons doivent aussi provenir des zones les plus fortement alopéciques
Cas particulier de l’adénite sébacée : les zones séborrhéiques sans alopécie, si encore présentes, sont à prélever en plus des zones alopéciques.
– Dermatite/dermatose avec hyperkératose : les foyers avec forte kératose sont à privilégier tout en évitant les zones nettement inflammées.
Si la truffe et/ou les coussinets sont les seules zones affectées, les biopsies doivent préférentiellement se faire en région des ailes du nez ou en marge des coussinets portant le moins de poids (par exemple coussinet du tarse ou du carpe) et avec un trépan de petit diamètre (4 mm).
– Maladie impliquant le pannicule adipeux : une biopsie excisionnelle est préférable pour mieux prélever le tissu sous-cutané.
– Griffes : si une mycose est suspectée seule la griffe peut être envoyée. En revanche, si de nombreuses griffes sont affectées, il faut envisager une amputation de la troisième phalange avec sa gaine unguéale (de préférence un ergot s’il est également lésionnel)
– Bande coronaire chez le cheval : la biopsie doit être superficielle (corne/derme très superficiel) et pour ce faire être réalisée de préférence au scalpel pour ne pas créer de défaut permanent de la boite cornée.
– Lésions ulcéreuses : les biopsies doivent être réalisées à la fois au centre de la zone ulcéreuse et à la jonction entre zone ulcéreuse et tégument sain. Si des zones érythémateuses sont présentes en parallèle des lésions ulcéreuses, elles doivent également être prélevées.
Biopsies endométriales équines :
Les biopsies peuvent-être réalisées à n’importe quel stade du cycle œstral. Il conviendra cependant d’attendre un délai de minimum trois semaines après la parturition ou l’avortement pour réaliser une biopsie endométriale. Une ou deux biopsies d’un à deux centimètres d’une corne utérines sont suffisantes. Les biopsies sont réalisées avec une pince spéciale à biopsie utérine via le vagin et cervix. La pince à biopsie peut être écouvillonnée pour analyse bactériologique après retrait de la biopsie.
Biopsies musculaires :
Lors de suspicion de myosite, myopathie de stockage ou carentielle, les biopsies musculaires peuvent être fixées au formol. Si une myopathie rare est suspectée ou la présentation clinique est inhabituelle, la congélation des biopsies musculaires est alors recommandée mais nécessite l’acheminement de la biopsie à un laboratoire spécialisé dans un délai de moins de 24h.
Le prélèvement chirurgical est préférable à la biopsie à l’aiguille. A titre indicatif, l’échantillon doit mesurer 1-3 cm de long x 1 cm de diamètre. L’échantillon doit être posé sur un morceau de carton ou un abaisse-langue avant d’être trempé dans le formol pour faciliter les recoupes selon les incidences transverse et longitudinale au laboratoire.
Chez le cheval, lors de suspicion de syndrome de rhabdomyolyse (incluant la myopathie par surcharge en polysaccharides équine) les muscles semi-tendineux ou semi-membraneux sont préférentiellement biopsiés. Lors de maladie du neurone moteur équine ou suspicion de maladie par déficience en vitamine E, le muscle sacro-caudalis est privilégié.
Biopsies digestives chez le cheval :
Un minimum de trois biopsies concernant la muqueuse est recommandé pour les biopsies gastriques et duodénales.
Un minimum de deux biopsies d’1 à 2 cm de long, comprenant la muqueuse et la partie superficielle de la sous-muqueuse superficielle est recommandé pour les biopsies rectales. La pince à biopsie utérine d’une longueur de 62 cm est par exemple utilisée pour l’échantillonnage. L’échantillonnage est réalisé à 20-30 cm de l’anus (région extra-péritonéale) et en zone dorso-latérale (11h et 13h). Une main dans le rectum sert recouvrir et ainsi protéger l’extrémité de la pince lors de son avancement dans la lumière rectale puis permet de placer un bourrelet de la partie superficielle de la paroi rectale entre les mors de la pince.
Biopsies digestives chez les carnivores :
La multiplicité des échantillons biopsiques (3 à 5 par zone) permet de faciliter le diagnostic. Les échantillons des différents étages prélevés peuvent être mis dans un même flacon.
Os :
La page dédiée du site internet du Dr vétérinaire David Jacques est consultable avec le lien suivant pour plus d’information à ce sujet : Biopsie osseuse
Le traitement technique des pièces osseuses est plus long que celui d’autres échantillons car un processus lent de décalcification est nécessaire avant la coupe du tissu.
Moëlle osseuse :
Le myélogramme et la biopsie de moëlle osseuse sont des examens qui se complémentent et doivent donc être systématiquement réalisés de façon conjointe. Un frottis sanguin est également requis dans le cadre d’une exploration d’une pathologie médullaire.
Les sites de biopsie envisageables sont les suivants :
Chevaux : aile de l’ilium pour les poulains, sternum pour les adultes ou jonction costo-chondrale
Chiens, chats, furets : tête humérale pour les chiens adultes obèses (pas chez les animaux en croissance pour ne pas léser la plaque de croissance), ilium chez les jeunes, partie proximale du fût huméral chez les furets, petits chiens et chats.
Œil :
L’œil doit être transmis dans son intégralité si possible sans incision préalable.
Autopsie :
Les organes vitaux (cœur, foie, poumon, rein) et au moins un organe lymphoïde (rate et/ou nœuds lymphatiques, éventuellement thymus chez les jeunes individus) doivent être transmis en plus des sites présentant des lésions évidentes à la macroscopie.
Pour les avortements et mortalité néonatales, se référer à la newsletter de mars 2018.