Les analyses canines & félines
Cytologie : prélèvement et interprétation
1. Prélèvement (par ponction avec et sans aspiration, impression, grattage et écouvillon) :
Une bonne contention de l’animal est nécessaire.
Dans certains cas, une sédation devrait être utilisée si le site de prélèvement est situé près de structures délicates (ex. ponction hépatique), ou si l’animal est agité voire agressif. Une anesthésie générale peut être recommandée lorsqu’une immobilité complète est nécessaire (ex. : ponction de moelle osseuse). Pour une ponction cutanée, le site doit être propre et un léger nettoyage avec un tampon d’alcool est généralement suffisant. Une préparation chirurgicale du site de ponction devrait être effectuée si une culture bactériologique est envisagée ou si une cavité corporelle est pénétrée (ex. thorax, abdomen, articulation). La ponction à l’aiguille fine sans aspiration est la technique de choix pour la majorité des masses cutanées ainsi que pour de nombreux autres sites et tissus. Elle s’effectue par simple ponction de la lésion en utilisant une technique sans aspiration (avec aiguille démontée) ou une technique avec aspiration en employant une seringue attachée à l’aiguille. Les calibres d’aiguille recommandés sont de 21-G à 23- G, le calibre 22-G étant adéquat dans la majorité des cas (photo 1).

Le prélèvement s’effectue par l’exécution de nombreux mouvements de « va-et-vient » afin d’introduire des cellules et des fragments tissulaires dans l’aiguille. Il est recommandé de changer l’orientation de l’aiguille plusieurs fois au cours du prélèvement (photos 2). Pour des lésions dont le diamètre excède 1,5 cm, plusieurs parties de la lésion devraient être ponctionnées afin d’obtenir un échantillon plus représentatif. Enfin, lors du prélèvement « va-et-vient », il faut veiller à ne pas faire sortir l’aiguille de la lésion afin d’éviter que l’échantillon ne soit contaminé par des cellules cutanées ou adipeuses.

Un prélèvement par aspiration peut être utilisé si la ponction avec aiguille démontée ne permet pas d’obtenir un échantillon suffisamment cellulaire. La lésion est d’abord ponctionnée avec une aiguille fixée à une seringue dont le piston est préalablement rempli d’air (2 à 5 ml). La présence d’air dans la seringue permet d’éjecter rapidement l’échantillon contenu dans l’aiguille, de façon à éviter que la formation d’un caillot ne séquestre les cellules à examiner. Une fois le tissu pénétré, une pression négative est exercée à plusieurs reprises en retirant le piston jusqu’au 3/4 du volume de la seringue pour favoriser le détachement cellulaire/tissulaire. Une pression négative excessive doit être évitée pour ne pas rompre les vaisseaux environnants et ainsi causer une contamination sanguine périphérique. Comme pour la méthode sans aspiration, il est recommandé de changer l’orientation de l’aiguille dans le but d’obtenir un échantillon représentatif de la lésion.
Les impressions et les grattages peuvent être utilisés pour échantillonner des lésions cutanées superficielles, ou des lésions profondes obtenues en chirurgie ou en nécropsie.
Les impressions de lésions cutanées s’effectuent simplement en y apposant une lame et en exerçant une légère pression de telle sorte que les cellules adhèrent par capillarité. Pour un prélèvement à partir d’une biopsie, une nouvelle coupe dans le tissu est préparée et l’excès de fluides tissulaires et de sang est épongé à l’aide de papier absorbant. On prélève ensuite une petite section du tissu que l’on applique à plusieurs reprises sur la surface d’une lame de verre que l’on fait ensuite sécher à l’air libre.
Les grattages cutanés peuvent se réaliser au moyen d’une lame de bistouri émoussée en effectuant des mouvements de façon unidirectionnelle et perpendiculairement à la surface de la lésion. Le matériel récolté est ensuite déposé sur une lame de verre puis étalé. Idéalement, le grattage doit être suffisamment profond pour provoquer une exsudation de fluides tissulaires ou un léger saignement à la surface de la peau. L’impression est une méthode de prélèvement appropriée pour la recherche et l’identification de micro-organismes (bactéries, spores et hyphes fongiques). Le grattage est une technique particulièrement indiquée pour les lésions sèches et sans relief ou au niveau de certaines surfaces (ex. cornée ou conjonctive après anesthésie locale). Lors d’impression et de grattage, les couches cellulaires superficielles sont souvent les seules à être échantillonnées. De ce fait, les cellules plus profondes peuvent ne pas être représentées avec ces techniques, ce qui peut mener à un diagnostic erroné ou incomplet.
L’écouvillon est essentiellement utilisé pour les lésions fistuleuses, le canal auriculaire, les passages nasaux, les lésions de la cavité orale et le tractus génital externe (détermination du stade du cycle reproducteur). Il est légèrement humecté avec de la saline stérile, puis roulé ou frotté contre la surface à échantillonner. Le matériel est déposé sur une lame (par roulement) pour l’examen cytologique. Cette technique est peu utile pour le diagnostic de conditions néoplasiques.
2. Etalement de l’échantillon sur lame, séchage et coloration :
L’étalement de l’échantillon sur la lame doit se faire rapidement pour éviter que l’échantillon ne coagule ou ne se dessèche.
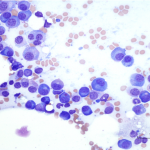
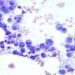
Il devrait fournir une couche monocellulaire constituée de cellules intactes pour permettre un examen cytologique optimale. Après le prélèvement, le contenu de l’aiguille est éjecté sur une lame de verre propre sur laquelle une deuxième lame est déposée délicatement et perpendiculairement à la première (photos 1 et 2 ci-dessous). L’échantillon est étalé en faisant glisser les deux lames l’une par rapport à l’autre. Idéalement, l’éjection du matériel doit se faire doucement et à proximité de la lame pour éviter une dispersion en « éclat d’obus » difficile à étaler (photo 3 ci-dessous). Il est important de ne pas appliquer une pression trop forte afin d’éviter une éventuelle rupture cellulaire. Certaines cellules, comme les lymphocytes néoplasiques, sont particulièrement fragiles et peuvent facilement se rompre au moment de l’étalement. La présence de nombreux noyaux libres sans cytoplasme, avec une grande quantité de filaments nucléaires, s’observent fréquemment si l’étalement a été effectué avec trop de pression (photos 4 et 5 ci-dessous). La présence d’une proportion importante de cellules éclatées est une cause fréquente d’échantillons non diagnostiques.
Le séchage de la lame contenant le matériel étalé doit se faire rapidement, en agitant la lame au contact de l’air.
Plusieurs lames devraient être préparées pour chaque lésion prélevée. Une ou deux lames d’une série peuvent être colorées et examinées au microscope par le praticien pour évaluer la cellularité de l’échantillon, la qualité de l’étalement et pour obtenir un diagnostic préliminaire. Les colorants de type rapide comme le Diff-Quick ou le RAL sont généralement utilisés pour la coloration cytologique de routine. Les lames colorées et non colorées sont ensuite envoyées au laboratoire dans une protection rigide (sans déposer de lamelle sur les lames à examiner).

Conditions de prélèvement :
Les liquides doivent être placés dans un tube EDTA (sauf LCS tube sec), expédiés au laboratoire sous 2-3 jours (sauf LCS voir ci-dessous), et maintenus au frais jusqu’à l’envoi. Si une bactériologie/mycologie est demandée conjointement, un tube sec devra être joint. Les PCR éventuelles seront réalisées sur le tube EDTA.
Une quantité suffisante de liquide (minimum 1-2 ml) est nécessaire pour la préparation de lames par cytocentrifugation, et pour la détermination du comptage cellulaire et du taux protéique au laboratoire.
Afin de préserver la morphologie des cellules contenues dans le liquide, deux manipulations très utiles peuvent être réalisées à la clinique :
1. Envoi au laboratoire de lames réalisées rapidement après avoir récolté le liquide.
Si le liquide apparaît opaque et de cellularité élevée (ex. péritonite, arthrite), un frottis direct peut être effectué.
Si le liquide semble peu cellulaire (ex. lavage), une partie de celui-ci peut être centrifugée (dans un tube à fond conique si possible) : les cellules concentrées au niveau du culot sont ensuite prélevées avec une pipette en plastique (en retirant le surnageant et en laissant 0.25 – 0.5 ml dans le fond du tube), puis déposées sur une lame et étalées comme un frottis.
2. Pour les liquides cérébrospinaux, il est recommandé d’ajouter du sérum du même animal (autologue) directement dans le liquide récolté (environ 10% du volume de l’échantillon récolté soit généralement 2-3 gouttes de sérum). Ce liquide pourra ensuite être envoyé au laboratoire pour réaliser l’examen cytologique. Un second tube contenant le LCS non modifié (sans ajout de serum) sera nécessaire pour la détermination du taux protéique.


* Procédures réalisées seulement si du liquide est reçu au laboratoire dans des conditions adéquates